
| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能:kJ/mol | 243 | 436 | 431 | 946 |
| ①-② |
| 2 |
| △H2-△H2 |
| 2 |
| △H2-△H2 |
| 2 |


科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
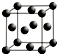 A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大.已知A的一种核素的质量数等于其质子数;E原子最外层电子数为其电子层数的两倍,C、E是同主族元素;B的第一电离能大于C的第一电离能;D离子在同周期离子中半径最小.G的最外层电子排布图为
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大.已知A的一种核素的质量数等于其质子数;E原子最外层电子数为其电子层数的两倍,C、E是同主族元素;B的第一电离能大于C的第一电离能;D离子在同周期离子中半径最小.G的最外层电子排布图为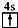 ,其余各能层电子全充满.
,其余各能层电子全充满.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.1NA 个CO32-的Na2CO3固体的质量为10.6g |
| B、含1mol 溶质的盐酸溶液与足量Fe反应,消耗NA个Fe原子 |
| C、0.1mol?L-1的稀硫酸中含有SO42-个数为0.1NA |
| D、标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、148g/mol |
| B、24g/mol |
| C、74g/mol |
| D、40g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com