
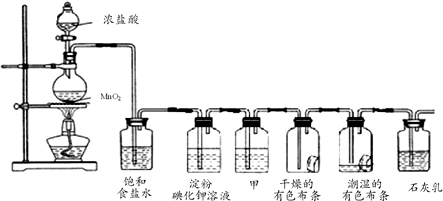
 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:分析 装置A是发生装置过氧化钠和浓盐酸反应产生黄绿色气体,说明生成氯气,一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体为氧气,反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色,把生成的气体全部赶出,
(1)KClO3氧化浓盐酸发生氧化还原反应,氯酸钾是氧化剂,浓盐酸为还原剂,反应生成氯化钾,氯气和水;
(2)O2、Cl2都具有强氧化性,都能将碘离子氧化为I2,I2遇淀粉试液变蓝色,HClO有漂白性,氯气和水反应生成HClO;
(3)n(Na2S2O3)=0.1mol/L×0.025L=0.0025mol,氯气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,二者完全反应时转移电子相等,设硫代硫酸根离子被氧化后硫元素的化合价为x,0.01mol×2×(1-0)=0.0025mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,结合氧化还原反应电子守恒、原子守恒、电荷守恒配平书写离子方程式;
(4)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式;
(5)利用Na2O2与浓盐酸反应制得的Cl2中通常含有的杂质气体,是过氧化钠和水反应生成氧气,浓盐酸易挥发;
解答 解:(1)KClO3氧化浓盐酸发生氧化还原反应,氯酸钾是氧化剂,浓盐酸为还原剂,反应生成氯化钾,氯气和水,反应的化学方程式为:KClO3++6HCl(浓)═KCl+3Cl2↑+3H2O,
故答案为:KClO3++6HCl(浓)═KCl+3Cl2↑+3H2O;
(2)装置B中为湿润的KI-淀粉试纸,反应一段时间后试纸变蓝,碘离子易被氧化,氧气可把碘离子氧化,反应方程式为:4H++O2+4I-=2I2+2H2O,故湿润的碘化钾-淀粉试纸变蓝不能说明有氯气生成,装置C中湿润的红色布条褪色,说明有次氯酸生成,氯气和水反应生成次氯酸和盐酸,故A中生成了氯气,
故答案为:不能,4H++O2+4I-=2I2+2H2O,HClO;
(3)n(Na2S2O3)=0.1mol/L×0.025L=0.0025mol,氯气的物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,二者完全反应时转移电子相等,设硫代硫酸根离子被氧化后硫元素的化合价为x,0.01mol×2×(1-0)=0.0025mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,电子转移总数为8e-,反应的氯气为4mol,反应的离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-,
故答案为:S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-;
(4)根据元素守恒知,生成物中还有水生成,该反应中O元素化合价由-1价变为-2价、Cl元素化合价由-1价变为0价,根据转移电子相等配平方程式为:Na2O2+4HCl═Cl2+2NaCl+2H2O,
故答案为:Na2O2+4HCl═Cl2+2NaCl+2H2°;
(5)利用Na2O2与浓盐酸反应制得的Cl2中通常含有的杂质气体,是过氧化钠和水反应生成氧气,浓盐酸易挥发,所以通常含有的杂质气体有氧气和氯化氢气体,
故答案为:HCl、O2;
点评 本题考查性质实验探究,侧重考查学生动手操作、分析问题能力,物质的性质是实验设计的依据,性质、制备实验方案设计是高考高频点,综合性较强,涉及知识点较多,熟练掌握元素化合物知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .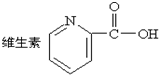 中的含氧官能团的名称是:羧基 中的含氧官能团的名称是:羧基 | |
| B. | 分子式为C4H8的烃中一定含有官能团碳碳双键 | |
| C. | 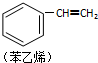 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) | |
| D. | 丙烯的结构简式可以表示为:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2溶液 | B. | 浓的CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
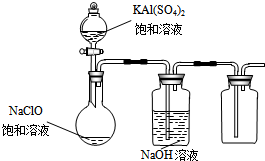 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应 SO42-+Ba2+═BaSO4↓ | |
| B. | 氢氧化钠溶液与稀硫酸反应 OH-+H+═H2O | |
| C. | 铁与氯化铁溶液反应 Fe+Fe3+═2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 10 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com