
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。常温条件下反应时,溶液pH 随时间变化的曲线如图所示。下列判断错误的是
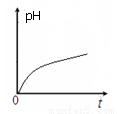
A.该反应的氧化剂是ClO-
B.该反应中有两种离子生成
C.该反应生成1mol氧化产物时,转移的电子为6 mol
D.参加反应的氧化剂与还原剂的物质的量之比为2 : 3
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:选择题
下列分离或提纯物质的方法中,正确的是
A.除去KC1中的K2CO3,可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即可
B.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
C.用冷却结晶的方法提纯含有少量KC1的KNO3
D.通过点燃可除去CO2中混有的CO气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
某化学反应其△H= —122 kJ·mol-1,∆S== 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A、25℃时 Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
B、常温下,NaClO溶液显碱性的原因:ClO—+ H2O = HClO + OH—
C、2NO(g) + 2CO(g) = N2(g) + 2CO2(g),在常温下能自发进行,则该反应的△H >0
D、25℃时向水中加入少量NaOH后,由水电离出的c(H+)•c(OH—)不变
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三新考试大纲适应性考试化学卷(解析版) 题型:填空题
[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2• H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三新考试大纲适应性考试化学卷(解析版) 题型:选择题
化学在生产和生活中有着重要的作用。下列有关说法正确的是
A.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
B.含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中
C.施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D.最理想的“原子经济"就是原子利用率为100%
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第三次阶段测化学试卷(解析版) 题型:选择题
现有常温下水电离出的 c(H+)均为 1×10-11 mol/L 的 4 种溶液:①HCl 溶液;②CH3COOH溶液;③NaOH 溶液;④氨水。有关上述溶液的比较中,正确的是
A.向等体积溶液中分别加水稀释 100 倍后,溶液的 pH:③>④>②>①
B.等体积的①、②、③溶液分别与足量铝粉反应,生成 H2 的量①最小
C.②、③溶液等体积混合后,溶液显碱性
D.①、④溶液混合若 pH=7,则消耗溶液的体积:④>①
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市高新区高三12月月考化学试卷(解析版) 题型:填空题
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“ =”或“<”)。
=”或“<”)。
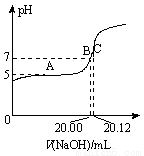
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:选择题
各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

A.②①③④ B.④③①② C.④②①③ D.③②④①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com