
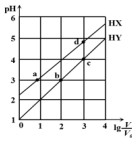
 在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )
在浓度均为0.1mol/L、体积均为V0的HX、HY,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | a、b两点的溶液中:c(X-)>c(Y-) | |
| B. | 相同温度下,电离常数K(HX):d>a | |
| C. | 溶液中水的电离程度:d>c>b>a | |
| D. | lg$\frac{V}{{V}_{0}}$=2时,若同时微热两种液体(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$ 增大 |
分析 A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质;
B.平衡常数只随温度变化,不随浓度变化,相同温度下,酸的电离平衡常数不变;
C.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小;
D.lg$\frac{V}{{V}_{0}}$=2,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等.
解答 解:A.根据图知,lg$\frac{V}{{V}_{0}}$=0时,HX的pH>1,说明HX部分电离为弱电解质,HY的pH=1,说明HY完全电离,为强电解质,HY的酸性大于HX,a、b两点的溶液中:c(X-)<c(Y-),故A错误;
B.酸的电离平衡常数只与温度有关,所以相同温度下,电离常数K( HX):a=d,故B错误;
C.酸或碱抑制水电离,酸中氢离子浓度越小其抑制水电离程度越小,根据图知,b溶液中氢离子浓度等于a,则水电离程度a=b,溶液中氢离子浓度:a=b>d>c,所以溶液中水的电离程度:a=b<d<c,故C错误;
D.lg$\frac{V}{{V}_{0}}$=2,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),n(X-)增大,n(Y-)不变,二者溶液体积相等,所以$\frac{\frac{n({X}^{-})}{V}}{\frac{n({Y}^{-})}{V}}$=$\frac{c({X}^{-})}{c({Y}^{-})}$变大,故D正确;
故选D.
点评 本题考查弱电解质电离,为高频考点,侧重考查学生分析推断及识图能力,正确判断两种酸的强弱是解本题关键,注意:酸的电离平衡常数只与温度有关,与溶液浓度无关,易错选项是D,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 任何烷烃分子中碳氢原子个数比都是相同的 | |
| B. | 烷烃的沸点随碳原子数增加而逐渐升高 | |
| C. | 丙烷与Cl2发生取代反应后生成的一氯代物不只是一种 | |
| D. | 正丁烷的熔点、沸点比异丁烷的高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
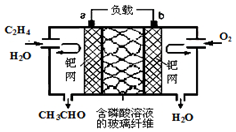 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
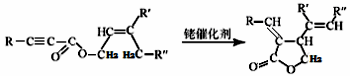 (R、R‘、R“表示氢、烷基或芳基)
(R、R‘、R“表示氢、烷基或芳基)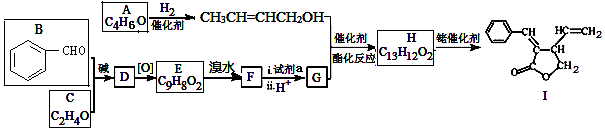
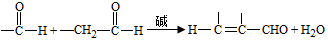
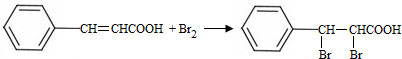 ;试剂a 是NaOH、醇溶液.
;试剂a 是NaOH、醇溶液.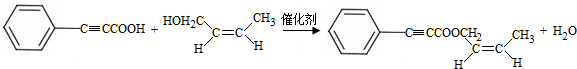 .
. (写出一种即可).
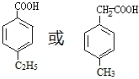
(写出一种即可).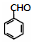 和CH3CHO为原料合成
和CH3CHO为原料合成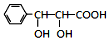 的合成路线流程图:
的合成路线流程图: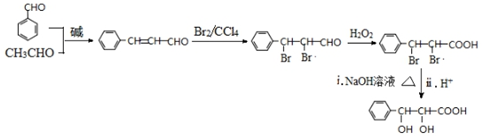 .(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
.(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$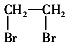 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
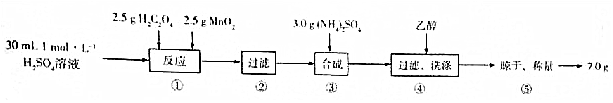
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与过量的氢氧化钙溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | 过氧化钠与水的反应:2 O22-+2H2O═4 OH-+O2↑ | |
| C. | 碳酸钙加入醋酸CO32-+2CH3COOH═CO2↑+2CH3COO-+H2O | |
| D. | 铁与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com