
碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下: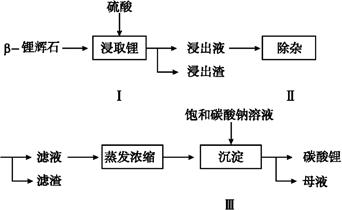
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 。
(5)从母液中可回收的主要物质是 。
(1)增大反应物间的接触面积,加快反应速率
(2)石灰石 (3)Fe2+、Mg2+、Ca2+
(4)2Li++ CO32—=Li2CO3↓ (5)Na2SO4
解析试题分析:(1)将固体物质粉碎,可增大反应物的接触面积,从而加快反应速率。
(2)加入石灰石能与溶液中的H+反应,使pH升高;加入CaCl2不能发生反应,故不能调节pH;加入稀H2SO4,增大了H+浓度,pH减小,此步骤中因pH为6.0~6.5可将Fe3+、Al3+除去。
(3)加入H2O2溶液,可将Fe2+氧化为Fe3+,加入石灰乳与Na2CO3溶液,可使Fe3+、Mg2+、Ca2+分别转化为沉淀而除去。
(4)由于Li2CO3溶解度相对较小,所以步骤Ⅲ中生成沉淀的离子方程式为CO32—+2Li+=Li2CO3↓。
(5)据(4)中步骤Ⅲ的反应实质可知,母液中可回收的主要物质为Na2SO4。
考点:以工艺流程为基础,考查化学反应原理、化学实验基本操作等


科目:高中化学 来源: 题型:填空题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图: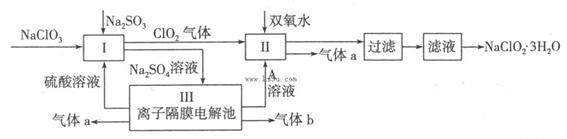
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。
(1)加MgO后过滤所得滤渣的主要成分为 。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? 。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,② ;③ ;④ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有 。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏 。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为 。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:BaSO4(s) + 4C(s)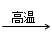 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
(方框内填写操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化镁可用于治疗胃酸过多,以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)该流程中进行了两次过滤操作,该操作所需的玻璃仪器有 。
(2)加入H2O2氧化时,发生反应的离子方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集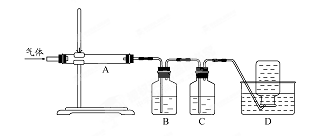
①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a NaOH 溶液 b Na2CO3溶液 c 稀硝酸 d 酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用某矿渣(主要成分为Cu2O,还含有Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
(固体混合物B经处理后可回收铜)
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐材质的仪器,除玻璃棒、酒精灯、泥三角外,还有_________(填仪器名称)。
(2)滤液A中铁元素的存在形式为_______(填离子符号),生成该离子的离子方程式为_____________________。
检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=_______。
(4) ①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→_____________________ _______→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水中含有极为丰富的自然资源。很多常见的金属元素和非金属元素主要以简单离子的形式存在于海水中,海水呈弱碱性。回答下列问题:
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是 ,目的是 ,步骤③用硫酸而不用盐酸酸化的原因可能是 ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
, , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com