
| A£® | Ņ»¶ØĢõ¼žĻĀ£¬2molSO2 ŗĶ 1molO2 »ģŗĻŌŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗóČŻĘ÷ÖŠµÄ·Ö×ÓŹż“óÓŚ2NA | |
| B£® | 256g S8 ·Ö×ÓÖŠŗ¬ S-S ¼üĪŖ 7NA øö | |
| C£® | ÓÉ 1molCH3COONa ŗĶÉŁĮæ CH3COOH ŠĪ³ÉµÄÖŠŠŌČÜŅŗÖŠ£¬CH3COO-ŹżÄæĪŖ NA øö | |
| D£® | 1 mol Na Óė O2 ĶźČ«·“Ó¦£¬Éś³É NaO2 ŗĶ Na2O2µÄ»ģŗĻĪļ£¬×ŖŅʵē×Ó×ÜŹżĪŖ NA øö |
·ÖĪö A£®¶žŃõ»ÆĮņÓėŃõĘų·“Ӧɜ³ÉČżŃõ»ÆĮņĪŖæÉÄę·“Ó¦£¬²»ÄܽųŠŠµ½µ×£»
B£®Ņ»øöS8·Ö×ÓÖŠŗ¬8øöS-S¼ü£¬¾Ż“Ė¼ĘĖć³ö256g¾§ĢåÖŠŗ¬ÓŠµÄS-SµÄŹżÄ棻
C£®øł¾ŻµēŗÉŹŲŗćÅŠ¶Ļ£ŗČÜŅŗĪŖÖŠŠŌ£¬ĒāĄė×ÓÓėĒāŃõøłĄė×ÓÅضČĻąµČ£¬ŌņÄĘĄė×ÓÓė“×ĖįøłĄė×ÓĻąµČ£»
D£®ÄĘÓėŃõĘų·“Ó¦ĪŽĀŪÉś³ÉŃõ»ÆÄĘ»¹ŹĒ¹żŃõ»ÆÄĘ£¬Äʶ¼±äĪŖÄĘĄė×Ó£¬1molÄĘĶźČ«·“Ó¦Ź§Č„1molµē×Ó£®
½ā“š ½ā£ŗA£®¶žŃõ»ÆĮņÓėŃõĘų·“Ӧɜ³ÉČżŃõ»ÆĮņĪŖæÉÄę·“Ó¦£¬²»ÄܽųŠŠµ½µ×£¬ĖłŅŌŅ»¶ØĢõ¼žĻĀ£¬2molSO2 ŗĶ 1molO2 »ģŗĻŌŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗóČŻĘ÷ÖŠµÄ·Ö×ÓŹż“óÓŚ2NA£¬¹ŹAÕżČ·£»
B.256g S8¾§Ģåŗ¬ÓŠS8µÄĪļÖŹµÄĮæĪŖ1mol£¬1molS8ÖŠŗ¬ÓŠ8mol S-S¼ü£¬ŗ¬ÓŠµÄS-S¼üĪŖ8NAøö£¬¹ŹB“ķĪó£»
C£®ÓÉ1mol CH3COONaŗĶÉŁĮæCH3COOHŠĪ³ÉµÄÖŠŠŌČÜŅŗÖŠ£¬ŗ¬ÓŠ1molÄĘĄė×Ó£»øł¾ŻµēŗÉŹŲŗć£¬ČÜŅŗĪŖÖŠŠŌ£¬ĒāĄė×ÓÓėĒāŃõøłĄė×ÓĪļÖŹµÄĮæĻąµČ£¬ŌņÄĘĄė×ÓÓėCH3COO-µÄĪļÖŹµÄĮæĻąµČ£¬ĖłŅŌČÜŅŗÖŠŗ¬ÓŠCH3COO-µÄĪļÖŹµÄĮæĪŖ1mol£¬ŗ¬ÓŠµÄCH3COO-ŹżÄæĪŖNAøö£¬¹ŹCÕżČ·£»
D.1molNaĶźČ«·“Ó¦Ź§Č„1molµē×Ó£¬ĪŽĀŪ²śĪļĪŖŃõ»ÆÄĘ»¹ŹĒ¹żŃõ»ÆÄĘ£¬×ŖŅʵĵē×ÓŹż¶¼ĪŖ1mol£¬×ŖŅʵē×Ó×ÜŹżNAøö£¬¹ŹDÕżČ·£»
¹ŹŃ”£ŗB£®
µćĘĄ ±¾Ģā漲鰢·ü¼ÓµĀĀŽ³£ŹżµÄÓŠ¹Ų¼ĘĖćŗĶÅŠ¶Ļ£¬×¢ŅāÕĘĪÕŗĆŅŌĪļÖŹµÄĮæĪŖÖŠŠÄµÄø÷»ÆѧĮæÓė°¢·ü¼ÓµĀĀŽ³£ŹżµÄ¹ŲĻµ£¬×¢ŅāČÜŅŗÖŠµēŗÉŹŲŗć¹ęĀɵÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
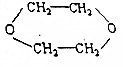 £¬Š“³öø÷²½·“Ó¦µÄ»Æѧ·½³ĢŹ½£ØŅ»¶ØŅŖ×¢Ć÷·“Ó¦Ģõ¼ž£¬ÓŠ»śĪļŅ»¶ØŅŖŠ“½į¹¹¼ņŹ½£©£ØĢįŹ¾£ŗµē½āŹ³ŃĪĖ®æɵĆNaOH£¬Cl2ŗĶH2£©
£¬Š“³öø÷²½·“Ó¦µÄ»Æѧ·½³ĢŹ½£ØŅ»¶ØŅŖ×¢Ć÷·“Ó¦Ģõ¼ž£¬ÓŠ»śĪļŅ»¶ØŅŖŠ“½į¹¹¼ņŹ½£©£ØĢįŹ¾£ŗµē½āŹ³ŃĪĖ®æɵĆNaOH£¬Cl2ŗĶH2£©²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2 | B£® | 8 | C£® | 16 | D£® | 18 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
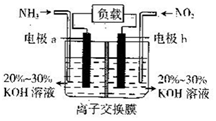 ĄūÓĆ·“Ó¦6NO2+8NH3=7N2+12H2O¹¹³Éµē³ŲµÄ·½·Ø£¬¼ČÄÜŹµĻÖÓŠŠ§Ļū³żµŖŃõ»ÆĪļµÄÅÅ·Å£¬¼õÉŁ»·¾³ĪŪČ¾£¬ÓÖÄܳä·ÖĄūÓĆ»ÆѧÄÜ£¬×°ÖĆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµÕżČ·ŹĒ£Ø””””£©
ĄūÓĆ·“Ó¦6NO2+8NH3=7N2+12H2O¹¹³Éµē³ŲµÄ·½·Ø£¬¼ČÄÜŹµĻÖÓŠŠ§Ļū³żµŖŃõ»ÆĪļµÄÅÅ·Å£¬¼õÉŁ»·¾³ĪŪČ¾£¬ÓÖÄܳä·ÖĄūÓĆ»ÆѧÄÜ£¬×°ÖĆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµÕżČ·ŹĒ£Ø””””£©| A£® | µēĮ÷“Óµē¼«a¾¹żøŗŌŲŗóĮ÷Ļņµē¼«b | |
| B£® | ĪŖŹ¹µē³Ų³ÖŠų·Åµē£¬Ąė×Ó½»»»Ä¤Ö»ŌŹŠķŅõĄė×ÓĶعż | |
| C£® | µē¼«aµÄµē¼«·“Ó¦Ź½ĪŖ2NH3-6e-=N2+6H- | |
| D£® | ŹŅĪĀĻĀ£¬µ±ÓŠ4.48 L NO2±»“¦ĄķŹ±£¬×ŖŅʵē×ÓĪŖ0.8 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HClµÄµē×ÓŹ½£ŗ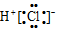 | B£® | HClOµÄ½į¹¹Ź½£ŗH-Cl-O | ||
| C£® | NH4IµÄµē×ÓŹ½£ŗ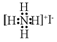 | D£® | ¼×Ķé·Ö×ÓĒņ¹÷Ä£ŠĶ£ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
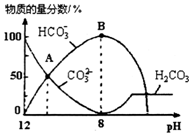 25”ꏱ£¬H2CO3µÄKal=4.2”Į10-7£¬Ka2=5.6”Į10-11£®ŹŅĪĀĻĀĻņ10mL 0.1mo1•L-1Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1mo1•L-1HClČÜŅŗ£®ČēĶ¼ŹĒČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲĪ¢Į£ĪļÖŹµÄĮæ·ÖŹżĖępH½µµĶ¶ų±ä»ÆµÄĶ¼Ļó£ØCO2ŅņÓŠŅŻ³öĪ“»³ö£©£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
25”ꏱ£¬H2CO3µÄKal=4.2”Į10-7£¬Ka2=5.6”Į10-11£®ŹŅĪĀĻĀĻņ10mL 0.1mo1•L-1Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1mo1•L-1HClČÜŅŗ£®ČēĶ¼ŹĒČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲĪ¢Į£ĪļÖŹµÄĮæ·ÖŹżĖępH½µµĶ¶ų±ä»ÆµÄĶ¼Ļó£ØCO2ŅņÓŠŅŻ³öĪ“»³ö£©£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | AµćĖłŹ¾ČÜŅŗµÄpH£¼11 | |
| B£® | BµćĖłŹ¾ČÜŅŗ£ŗc£ØNa+£©=c£ØHCO3-£©+c£ØCO32-£©+c£ØH2CO3£© | |
| C£® | Aµć”śBµć·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCO32-+H+ØTHCO3- | |
| D£® | ·Ö²½¼ÓČė·ÓĢŖŗĶ¼×»ł³Č£¬ÓƵĪ¶Ø·Øæɲā¶ØNa2CO3ÓėNaHCO3»ģŗĻĪļµÄ×é³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓŠ“óĮæµÄĀČĘųŠ¹Ā©Ź±£¬ÓĆÉÕ¼īČÜŅŗ½žŹŖČķ²¼ĆÉĆę£¬²¢ŃøĖŁĄėæŖĻÖ³” | |
| B£® | ½šŹōÄĘ×Å»šČ¼ÉÕŹ±£¬ÓĆÅŻÄĆš»šĘ÷Ćš»š | |
| C£® | ÉŁĮæÅØĮņĖįÕ“ŌŚĘ¤·ōÉĻ£¬Į¢¼“ÓĆĒāŃõ»ÆÄĘČÜŅŗ³åĻ“ | |
| D£® | ¹żĀĖŹ±£¬²£Į§°ōÓėČż²ćĀĖÖ½µÄŅ»±ß½Ó“„ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com