
【题目】化合物H是合成治疗心血管疾病药物的中间体,可通过以下途径合成:

(1)写出C中官能团的名称:_______________。
(2)写出有关反应类型:B→C:_________;F→G:________。
(3)写出A→B反应方程式:____________________________________。
(4)同时满足下列条件的D同分异构体的结构简式为_______________________。
①能发生银镜反应②能发生水解反应,水解产物之一与FeC13溶液显紫色
③核磁共振氢谱(1 H—NMR)显示分子中有4种不同化学环境的氢。
(5)合成途径中,C转化为D的目的是__________________。
(6)参照上述合成路线,以甲苯和(CH3CO)2O为原料(无机试剂任选),设计制备

的合成路线____________________________________。
【答案】 醚键、氨基 还原反应 消去反应 
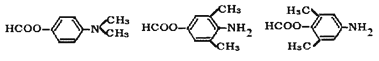 保护氨基,防止合成过程中被氧化
保护氨基,防止合成过程中被氧化 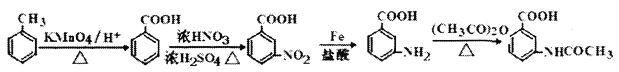
【解析】(1)根据C的结构简式可知C中官能团的名称为氨基和醚键。(2)B→C是硝基转化为氨基,属于还原反应;根据E和G的结构简式可知E生成F是羰基被还原为醇羟基,所以F→G是羟基的消去反应。(3)A→B是硝化反应,反应方程式为 。(4)①能发生银镜反应,说明含有醛基;②能发生水解反应,水解产物之一与FeC13溶液显紫色,即属于酚羟基形成的酯基,因此是甲酸形成的酯基,即苯环上一定存在-OOCH;③核磁共振氢谱(1 H—NMR)显示分子中有4种不同化学环境的氢,所以满足条件的有机物同分异构体结构简式为
。(4)①能发生银镜反应,说明含有醛基;②能发生水解反应,水解产物之一与FeC13溶液显紫色,即属于酚羟基形成的酯基,因此是甲酸形成的酯基,即苯环上一定存在-OOCH;③核磁共振氢谱(1 H—NMR)显示分子中有4种不同化学环境的氢,所以满足条件的有机物同分异构体结构简式为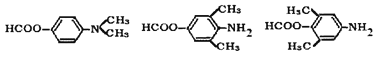 ;(5)由于最终还是转化为氨基,而氨基易被氧化,因此合成途径中,C转化为D的目的是保护氨基,防止合成过程中被氧化。(6)参照上述合成路线并依据逆推法可知,以甲苯和(CH3CO)2O为原料(无机试剂任选),制备
;(5)由于最终还是转化为氨基,而氨基易被氧化,因此合成途径中,C转化为D的目的是保护氨基,防止合成过程中被氧化。(6)参照上述合成路线并依据逆推法可知,以甲苯和(CH3CO)2O为原料(无机试剂任选),制备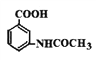 的合成路线为
的合成路线为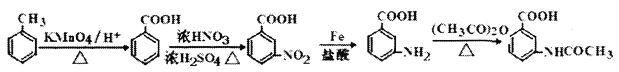 。
。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】实验室模拟工业制取Na2SO3固体的过程如下:

已知:① 反应I在三颈烧瓶中发生,装置如图甲所示(固定及加热类仪器省略)。
② 部分物质的溶解度曲线如图乙所示,其中Na2SO3饱和溶液低于50℃时析出Na2SO3·7H2O。
(l)反应I的目的是制取(NH4)2SO3溶液。

① 反应I的离子方程式为____________。
② 亚硫酸分解产生的SO2须冷却后再通入氨水中,目的是____________。
③ 下列关于图甲装置或操作的叙述正确的是______(填字母)。
A.接入冷凝管的冷却水从a端通入
B.长玻璃导管具有防倒吸的作用
C. 控制加热亚硫酸的温度,可以控制生成SO2气体的速率
(2)为获取更多的Na2SO3固体,要将反应II的温度控制在80℃左右,并_______(填操作I的名称)。
(3)由滤液可以制取NH4Cl固体。
①验证滤液中含有NH4+的实验操作是________。
②由滤液可获得NH4Cl粗产品(含少量Na2SO3)。请补充完整由NH4Cl粗产品制取纯净的NH4Cl固体的实验方案:________,得到纯净的NH4Cl固体。(实验中须使用的试剂有SO2、乙醇,除常用仪器外须使用的仪器有:真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
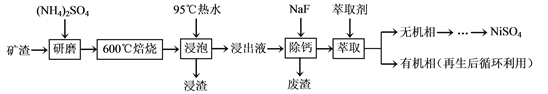
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
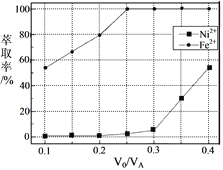
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁锅是有益于人类健康的理想炊具,其主要原因( )
A.价格便宜,不易生锈B.铁具有银白色光泽,导电性好
C.烹饪的食物中留有人体需要的铁元素D.传热慢,保温性能好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。

【实验探究】
(1)实验室制取氨气应选用下图中________发生装置进行实验,反应的化学方程式为
_________________________

(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是____________________________________________________________。
(5)F装置中倒置漏斗的作用________________________________________________。
(6)某同学用右图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 ==7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备肥皂的过程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答:
(1)加入乙醇的目的是__________________________________________。
(2)证明油脂完全反应的方法是_____________________________________________________。
(3)以硬脂酸甘油酯为例,写出皂化反应的方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是 ( )。
A. 胶体带电荷,而溶液呈电中性
B. 胶体中加入电解质可产生沉淀,而溶液不能
C. 胶体是一种不稳定的分散系,而溶液是一种非常稳定的分散系
D. 胶体能够发生丁达尔效应,而溶液则不能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com