
已知热化学方程式:
H2O(g)=H2(g) + 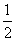 O2(g) △H = +241.8kJ/mol
O2(g) △H = +241.8kJ/mol
H2(g)+ 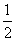 O2(g) = H2O(1) △H = -285.8kJ/mol
O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88kJ B.吸热2.44KJ C.放热44kJ D.吸热44KJ
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.78 g苯含有C===C键的数目为3 NA
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组模拟工业处理电镀含氰废水并测定处理的效率,利用如图所示装置进行实验.将CN﹣的浓度为0.2mol•L﹣1的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中,充分反应.打开分液漏斗活塞,滴入100mL稀H2SO4,关闭活塞.
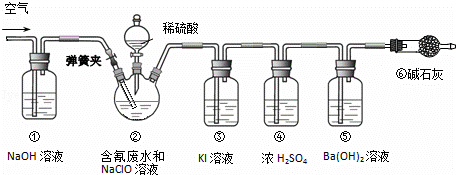
已知装置②中发生的主要反应依次为:
CN﹣+ClO﹣═CNO﹣+Cl﹣;2CNO﹣+2H++3C1O﹣═N2↑+2CO2↑+3C1﹣+H2O
(1)①和⑥的作用是 .
(2)装置②中,生成需由装置③除去的物质的离子方程式为 .
(3)反应结束后,缓缓通入空气的目的是 .
(4)为计算该实验中含氰废水被处理的百分率,需要测定 的质量.
(5)已知CN﹣的处理效率可高达90%,产生的CO2在标准状况下的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
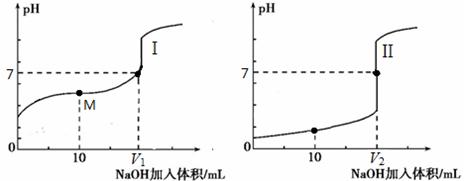
② 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
① 写出步骤2中溶液变红色的离子方程式 。
② 步骤3中现象a是 。
③ 用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质全部是弱电解质的是
A.H2SiO3 H2S CO2 B.MgSO4 CH3COOH CH3CH2OH
C.H2SO3 BaSO4 CH4 D.H2O NH3•H2O H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
在足量锌与等物质的量浓度、等体积的盐酸和醋酸反应时,下列叙述正确的是
A.开始反应时,二者的速率相等 B.盐酸放出的H2多
C.二者放出的H2一样多 D.醋酸消耗的Zn的质量多
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(g)+2B(g) C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强;②混合气体的密度;③各气体物质的物质量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量.
A.②③⑤ B.①②③ C.②③④⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+ )
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+ )>c(SO42 -)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯是重要化工原料,其产量是一个国家石油化工发展水平的标志。请回答:
(1)在一定条件下,乙烷和乙烯都能制备氯乙烷(C2H5Cl)。
①用乙烷制备氯乙烷的化学方程式是___________________________________________
________________,该反应的类型是________。
②用乙烯制备氯乙烷的化学方程式是__________________________________________
________________,该反应的类型是________。
比较上述两种方法,第________种方法更好。其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)此外,乙烯大量用来生产环氧乙烷,生产工艺主要有两种

根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,工艺一的原子利用率________100%(填“<”、“=”、“>”,下同);工艺二的利用率为________100%,因此,在实际生产中,采用工艺________更环保,更经济。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com