
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示变化的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Na | Na2O | NaOH | Na2O2 |
C | Fe | Fe3O4 | FeCl2 | FeCl3 |
D | S | FeS | SO2 | SO3 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+2Cl+5I2+4H2O。
③![]()

请回答:
(1) 仪器b在装置中的作用是________;比较仪器c和d,实验中c的优点是________。
(2) 制备装置甲中需改进的一项措施是________。
(3) 反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:________;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________。
(4) 下列有关说法正确的是________。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5) 自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0 mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000 mol·L1 Na2S2O3标准溶液滴定碘单质(I2+2S2O![]() =2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
=2I+S4O62—),达到滴定终点时用去15.00 mL Na2S2O3标准溶液,测得该水样中ClO2的含量为________mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
A.![]() 溶液与
溶液与![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
B.![]()
![]() 溶液与过量NaOH溶液反应:
溶液与过量NaOH溶液反应:![]()
C.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
D.![]() 溶液中加入过量的HI溶液:
溶液中加入过量的HI溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线上的主族元素性质相 似,这称为对角线规则。据此请回答:
(1)锂在空气中燃烧主要产物的电子式是_____________同时生成微量的________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,证明这一结论的有关离子方程式为____________________,_____________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式为____________________________。
(4)用电子式表示BeCl2的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将潮湿的Cl2通入如图所示装置中,一段时间后乙装置中红色干燥布条褪色。则甲装置中所盛试剂(足量)可能是( )
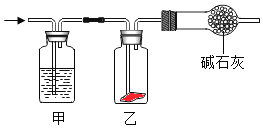
A.浓硫酸B.NaOH溶液C.KI溶液D.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________________(写出一条即可)。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,
随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,![]() 的转化率为______________。
的转化率为______________。
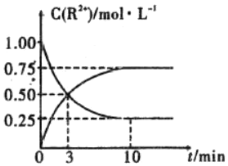
④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____________(不考虑离子水解的影响)。
=_____________(不考虑离子水解的影响)。
(2)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,为了将Mn2+的浓度降到![]() ,则加入的Na2S溶液的浓度至少是______________mol/L[已知
,则加入的Na2S溶液的浓度至少是______________mol/L[已知![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。

根据以上信息,回答下列问题:
(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有
(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。 转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断, 该试剂最好是_____。
①NaOH 溶液 ②KSCN 溶液 ③氯水和 KSCN 的混合溶液 ④pH 试纸 ⑤KMnO4 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
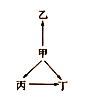
【题目】在一条河边有四座工厂:甲、乙、丙、丁(如图所示),它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种。某环保小组对河水监测时发现:

①甲处河水呈乳白色
②乙处河水有红褐色沉淀
③丙处河水由浑浊变澄清
④丁处河水产生气泡,河水仍澄清
请推断四座工厂排出的废液里含有的物质分别是(填化学式):
甲:___,乙:___,丙:___,丁:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120℃时,将0.1 mol 氢气、2.8 g一氧化碳和0.05 mol 氮气的混合气体与足量氧气充分燃烧后,立即将所得混合气体通过足量的过氧化钠粉末,固体质量增加
A.2.8 gB.3.0 gC.7.2 gD.5.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com