
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
分析 A.根据PM2.5和胶体粒子的直径大小判断;
B.制备玻璃发生反应:碳酸钠与二氧化硅高温下生成硅酸钠、二氧化碳,碳酸钙与二氧化硅高温反应生成硅酸钙和二氧化碳;
C.形成光化学烟雾和酸雨的重要原因是氮的氧化物;
D.二氧化硅为酸性氧化物,能够和强碱溶液反应.
解答 解:A.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,胶体粒子的直径在1-100nm之间,PM2.5在大小上包含胶体粒子,故A错误;
B.高温条件下反应易向着生成气体的方向进行,石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关,故B正确;
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因,故C正确;
D.二氧化硅能够和强碱溶液反应,光导纤维遇强碱会“断路”,高纯度的二氧化硅广泛用于制作光导纤维,故D正确;
故选:A.
点评 本题考查了生产生活中常见的污染与治理、硅及其化合物性质与用途,熟悉PM2.5成分、工业制造玻璃原理、化学烟雾和酸雨成因是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
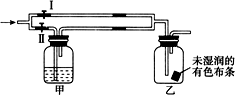 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
查看答案和解析>>
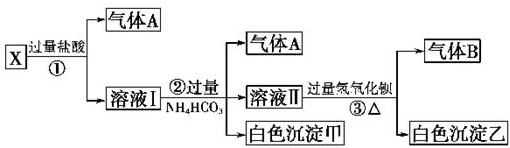
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z,而离子半径:Z>Y>W | |
| B. | 化合物丙中只存在共价键 | |
| C. | 测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 | |
| D. | 甲沸点远高于乙,可能是甲分子存在氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
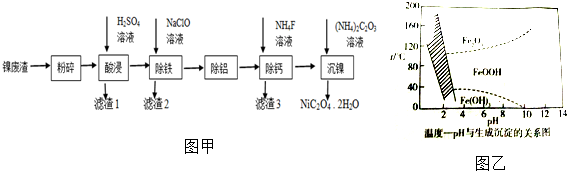
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
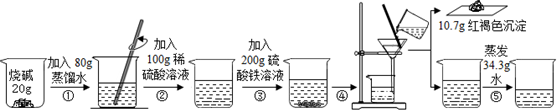
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com