
| A. | 还原剂是KClO3 | B. | HCl被还原 | ||
| C. | 得到3molCl2转移6mol电子 | D. | 氧化产物、还原产物都是Cl2 |
分析 KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
解答 解:A.Cl元素的化合价由+5价降低为0,则KClO3为氧化剂,故A错误;
B.Cl元素的化合价由-1价升高为0,则Cl为还原剂,故B错误;
C.由反应可知,得到3molCl2转移5mol电子,故C错误;
D.只有Cl元素的化合价变化,则氧化产物、还原产物都是Cl2,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意HCl的作用及氧化还原反应基本概念,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
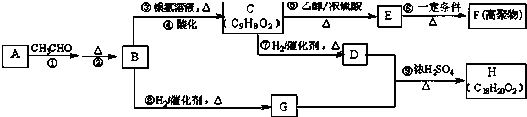
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应. ,加聚反应(或聚合反应).
,加聚反应(或聚合反应).查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$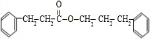 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石、石英和足球烯均为空间网状结构的原子晶体 | |
| B. | 在NaOH、NH4Cl和Na2S04中,都存在离子键和共价键 | |
| C. | 干冰升华的过程只需克服分子间作用力 | |
| D. | H20分解生成H2和O2的过程中既有共价键断裂,又有共价键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 2-甲基-1,3-丁二烯的键线式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )
常温下,向10mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH:溶液.有关微粒的物质的量变化如图(其中I代表、H2A,Ⅱ代表ⅡAⅢ代表A2-).根据图示判断,下列说法不正确的是( )| A. | 当V(NaOH)=10mL时,溶液中离子浓度的关系一有定:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 当V(NaOH)=15mL时,溶液中离子浓度的关系一定有:c(HA-)+2c(H+)+3c(H2A)=c(A2-)+2c(OH-) | |
| C. | 当V(NaOH)=15mL时,向溶液中滴加少量的盐酸或NaOH溶液,溶液的pH保持不变 | |
| D. | 当V(NaOH)=20mL时,向溶液中加水稀释,c(H+)减小,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
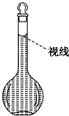 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向无色溶液中加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO${\;}_{4}^{2-}$ | |
| B. | 用pH试纸测定氯水的pH | |
| C. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| D. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com