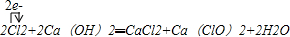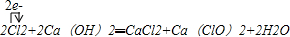合理利用化学反应可以造福人类.请写出下列反应的化学方程式.
(1)工业制取漂白粉的化学方程式(用单线桥标出电子转移的方向和数目) .洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,用化学方程式表示漂白粉溶于水后在空气中产生漂白性物质的反应 .
(2)燃煤锅炉将排放大量SO2,污染大气造成公害,常采用两种方法消除燃煤SO2的污染.
使排放的烟气通过氨水洗涤,化学方程式是 .
【答案】
分析:(1)根据工业制漂白粉的方法以及氧化还原电子得失守恒标出电子转移的方向和数目;漂白粉能与空气中的水和二氧化碳反应生成具有消毒作用的次氯酸;
(2)根据二氧化硫是酸性气体,能与碱溶液发生中和反应,消除对大气的污染.
解答:解:(1)工业制漂白粉是将氯气通入石灰乳中即可得到漂白粉(有效成份是次氯酸钙):2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O,反应中Cl
2既是氧化剂又是还原剂,2个Cl
2一个是氧化剂另一个是还原剂,所以转移电子数是2;漂白粉能与能与空气中的水和二氧化碳反应生成具有消毒作用的次氯酸:Ca(ClO)
2+H
2O+CO
2═CaCO
3↓+2HClO,
故答案为:

; Ca(ClO)
2+H
2O+CO
2═CaCO
3↓+2HClO;
(2)SO
2是酸性气体,能与碱溶液发生中和反应,气体通过碱液吸收后再排到大气中,消除对大气的污染:SO
2(少量)+H
2O+2NH
3═(NH
4)
2SO
3 或SO
2(过量)+H
2O+NH
3═NH
4HSO
3
故答案为:SO
2(少量)+H
2O+2NH
3═(NH
4)
2SO
3 或SO
2(过量)+H
2O+NH
3═NH
4HSO
3.
点评:本题主要考查化学方程式的书写,难度较小,明确物质的性质及发生的化学反应是解答的关键.

 ; Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;
; Ca(ClO)2+H2O+CO2═CaCO3↓+2HClO;