
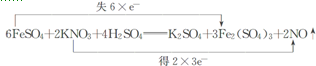 .
.分析 (1)判断化合价降低的反应物是氧化剂、化合价升高的反应物是还原剂,根据氧化剂得到的电子等于还原剂失去的电子来求x和y;
(2)根据化合价升降总数相等和质量守恒来配平方程式;
(3)根据化合价升高的反应物是还原剂,其对应产物为氧化产物;
(4)双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目;
(5)摩尔质量以g/mol作单位,数值上等于其相对分子质量;
根据n=$\frac{m}{M}$计算氨气的物质的量,根据N=nNA计算氨气分子数目,结合氨气分子含有的H原子数目计算氢原子物质的量;
根据n=$\frac{m}{M}$计算二氧化碳的物质的量,再根据m=nM计算氧气的质量.
解答 解:(1)n(FeSO4)=11.4g/152g•mol-1=0.075mol,KNO3的物质的量为0.05L×0.5mol•L-1=0.025mol,设NO3-与NxOy中N元素化合价差为a,根据得失电子总数相等的原则,可得关系式:0.075×1=0.025×a,所以a=3即NxOy中N元素化合价为+2价,NxOy为NO,所以x=y=1,
故答案为:1;1;
(2)FeSO4中铁的化合价由+2价升高为+3价,变化1,KNO3中氮的化合价由+5价降低为+2价,变化3,化合价升降总数相等和质量守恒来配平方程式:6FeSO4+2KNO3+4H2SO4=3Fe2(SO4)3+K2SO4+2NO↑+4H2O,
故答案为:6;2;4;3;1;2;4;
(3)FeSO4中铁的化合价由+2价升高为+3价,是还原剂,所以对应的产物Fe2(SO4)3是氧化产物,
故答案为:Fe2(SO4)3;
(4)双线桥的箭头始于反应物有关元素的原子或离子,箭头指向发生化合价变化后生成物中对应元素的原子或离子或原子团,要标明电子的得失字样及得失电子数目,此反应用双线桥法表示如下: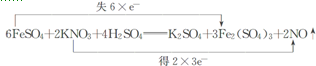 ,
,
故答案为: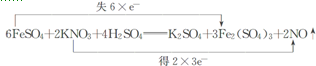 ;
;
(5)硝酸的摩尔质量为63g/mol;
3.4g氨气的物质的量=$\frac{3.4g}{17g/mol}$=0.2mol,
含有分子数目=0.2mol×NAmol-1=0.2NA,
含有H原子物质的量=0.2mol×3=0.6mol;
标况下,4.48L CO2的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
与其等物质的量的氧气的质量=0.2mol×32g/mol=6.4g,
故答案为:43g/mol;0.2;0.2NA;0.6;6.4.
点评 本题主要考查了氧化还原反应的配平、氧化产物的判断及分析氧化还原反应用,题目难度中等,注意基础知识的掌握,明确元素的化合价变化来分析是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 四个C-H键完全相同 | B. | CH4的一氯代物只有一种 | ||
| C. | CH2Cl2只有一种空间结构 | D. | 在常温常压下CH2Cl2为液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{9a}$ mol-1 | B. | 9a mol-1 | C. | 2a mol-1 | D. | 18a mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
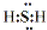 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
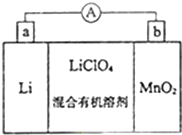 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com