
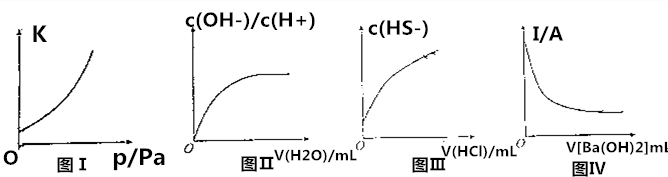
| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |
分析 A、化学平衡常数只与温度有关,温度不同,其平衡常数不变;
B、弱电解质中,加水促进电离,作为弱酸,溶液氢离子浓度减小,温度不变,氢氧根离子浓度增大,故$\frac{c(O{H}^{-})}{c({H}^{+})}$随着水的加入增大;
C、Na2S溶液中滴加稀盐酸至足量,先生成NaHS溶液,随着盐酸的量的增加,后生成H2S,故c(HS-)与盐酸体积的关系是先增大后减小;
D、稀硫酸与加入的Ba(OH)2溶液反应生成硫酸钡和水,硫酸钡不导电,水几乎不导电,恰好完全反应时,导电能力几乎为0,后再加入氢氧化钡强电解质,导电能力会逐渐增强.
解答 解:A、化学平衡常数只与温度有关,温度不同,其平衡常数不变,故A错误;
B、弱电解质中,加水促进电离,作为弱酸,溶液氢离子浓度减小,温度不变,氢氧根离子浓度增大,故$\frac{c(O{H}^{-})}{c({H}^{+})}$随着水的加入增大,故B正确;
C、Na2S溶液中滴加稀盐酸至足量,先生成NaHS溶液,随着盐酸的量的增加,后生成H2S,故c(HS-)与盐酸体积的关系是先增大后减小,故C错误;
D、稀硫酸与加入的Ba(OH)2溶液反应生成硫酸钡和水,硫酸钡不导电,水几乎不导电,恰好完全反应时,导电能力几乎为0,后再加入氢氧化钡强电解质,导电能力会逐渐增强,故D错误.
故选B.
点评 本题考查化学平衡的图象、弱电解质的电离平衡、溶液的导电能力判断,明确外界条件对化学平衡的影响及图象中纵横坐标的含义,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液水解的方程式为:HS-+H2O?S2-+H3O+ | |
| B. | 向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| C. | 在100 mL 2 mol/L FeI2溶液中通入4.48 L氯气(标况下),充分反应:2I-+Cl2═I2+2Cl- | |
| D. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是18×7的格子,按要求作答
下面是18×7的格子,按要求作答| A | He | ||||||||||||||||
| G | C | D | |||||||||||||||
| B | E | F | I | H | |||||||||||||
| Fe | Cu | ||||||||||||||||
 ,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )
,C、D、E、F的简单离子半径由小到大顺序是Al3+<Mg2+<F-<O2-.(填写离子符号 )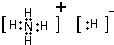 (填电子式).
(填电子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
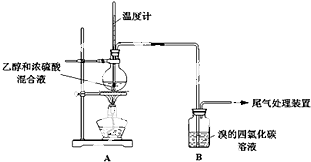
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
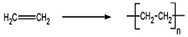 ,加聚反应.
,加聚反应.| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
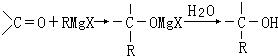
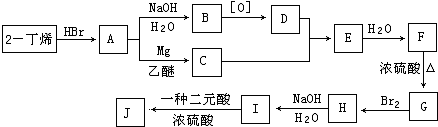
 .
. ,
,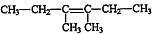 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$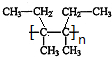 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com