
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 1mol/L×0.25L |
| 18.4mol/L |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
A、Na+的基态电子排布图是: |
| B、质量数之和比质子数之和大的水分子符号可能是:D218O |
C、Na2S的电子式: |
D、氯离子结构示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是( )| A、洗气或干燥装置:瓶内放一定体积溶液,由a管口进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由b管口进气 |
| C、提供少量CO:瓶内充满CO,b管口接自来水龙头 |
| D、H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
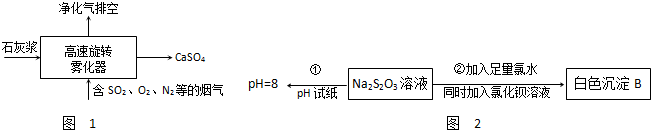
查看答案和解析>>
科目:高中化学 来源: 题型:
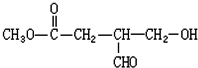
查看答案和解析>>
科目:高中化学 来源: 题型:
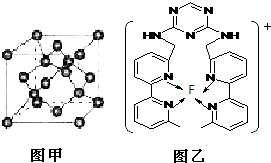 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.A元素能级个数与核外电子数相等,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com