
分析 (1)化学反应通常是试管、烧瓶、烧杯或锥形瓶中发生;
(2)不能直接受热的有:烧杯、烧瓶和锥形瓶;
(3)带塞子或活塞的仪器在使用前要查漏;
(4)物质的分离提纯的方法有:过滤、蒸发、蒸馏、萃取分液等.
解答 解:(1)化学反应通常是试管、烧瓶、烧杯或锥形瓶、坩埚、燃烧匙中发生的,故能用作反应容器的是①②④⑤⑥⑭,故答案为:①②④⑤⑥⑭;
(2)不能直接受热、必须垫石棉网加热的有:烧杯、烧瓶和锥形瓶,故用酒精灯加热时需垫石棉网的是①⑤⑥⑫,故答案为:①⑤⑥⑫;
(3)带塞子或活塞的仪器在使用前要查漏,故使用前要查漏的有:⑦⑧⑩⑬,故答案为:⑦⑧⑩⑬;
(4)物质的分离提纯的方法有:过滤、蒸发结晶、蒸馏、萃取分液等.过滤用到漏斗,蒸发结晶用到蒸发皿,蒸馏用到蒸馏烧瓶,萃取分液用到分液漏斗,故答案为:③⑧⑪⑫;
点评 本题考查了学生对常用仪器的掌握,难度不大,明确哪些仪器能直接加热,哪些仪器加热时需要垫石棉网,哪些仪器不能加热.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.5 mol N2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
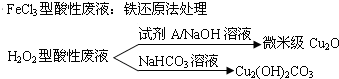
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化:
有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化: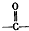 ,则H的结构简式可能为CH3CH2CHO、
,则H的结构简式可能为CH3CH2CHO、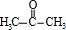 .
. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
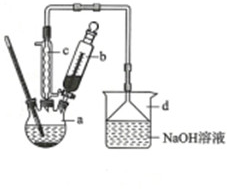
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .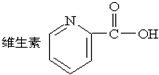 中的含氧官能团的名称是:羧基 中的含氧官能团的名称是:羧基 | |
| B. | 分子式为C4H8的烃中一定含有官能团碳碳双键 | |
| C. | 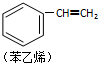 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) | |
| D. | 丙烯的结构简式可以表示为:CH3CHCH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com