
分析 由盐酸溶液pH=6,溶液中c(H+)=1×10-6mol/L,稀释10倍,此时溶液接近但不等于1×10-7mol/L,只能无限接近1×10-7mol/L;PH=9的稀氢氧化钠中c(OH-)=10-5mol/L,稀释100倍后,c(OH-)无限接近于1×10-7mol/L但不等于1×10-7mol/L,据此分析.
解答 解:盐酸溶液pH=6,溶液中c(H+)=1×10-6mol/L,稀释10倍,此时溶液中氢离子浓度接近但不等于1×10-7mol/L,只能无限接近1×10-7mol/L,故溶液的pH不等于7,但接近于7;PH=9的稀氢氧化钠中c(OH-)=10-5mol/L,稀释100倍后,c(OH-)无限接近于1×10-7mol/L但不等于1×10-7mol/L,故溶液的pH不等于7但接近于7.
答:PH=6的盐酸稀释10倍后,PH≠7;PH=9的稀氢氧化钠溶液100倍后,PH≠7.
点评 本题考查了溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,确定溶液中氢离子的近似浓度是关键,注意酸碱稀释接近中性应考虑水的电离.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

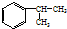 ,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是
,A的含有苯环的同分异构体(除A外)有7种,其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的同分异构体是 (写结构简式).
(写结构简式). +nHCHO$→_{△}^{催化剂}$
+nHCHO$→_{△}^{催化剂}$ +nH2O.
+nH2O. G:
G: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入饱和FeCl3溶液得到的红褐色液体 | |
| D. | 向NaOH溶液中通入CO2得到的无色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
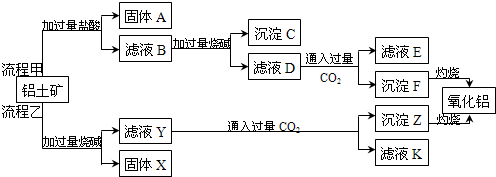
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
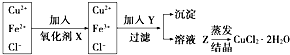 工业上制取纯净的CuCl2•2H2O的主要过程是:
工业上制取纯净的CuCl2•2H2O的主要过程是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
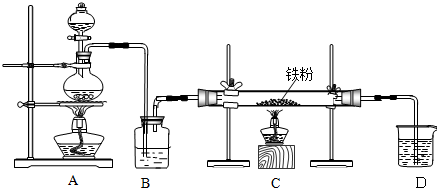
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com