
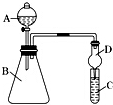
 利用如图装置可以验证非金属性的变化规律.
利用如图装置可以验证非金属性的变化规律.科目:高中化学 来源: 题型:
| A、同系物的化学性质相似 |
| B、同位素的化学性质几乎相同 |
| C、分子量相同的化合物不一定同分异构体 |
| D、同分异构体间的转化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
B、H2(g)+
| ||
C、H2(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中可以含有共价键 |
| B、共价化合物中可以含有离子键 |
| C、当元素处于最高价态时一定具有强氧化性 |
| D、元素的性质呈周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com