
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
已知下列热化学反应方程式:
① Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH =-24.8 kJ/mol
② Fe2O3(s)+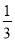 CO(g) =
CO(g) = 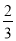 Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH =-15.73 kJ/mol
CO2(g) ΔH =-15.73 kJ/mol
③ Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH =+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
A.-218 kJ/mol B.-109 kJ/mol
C.+218 kJ/mol D.+109 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁架、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗。只应用上述仪器或用品,不能 进行的实验操作是
A.蒸发 B.萃取 C.过滤 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:填空题
(14分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3物质的量随时间的变化曲线。
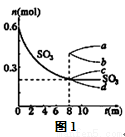
①平衡时,SO3的转化率为 (保留小数点后一位);T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
在恒容密闭容器中发生反应2NO2  2NO+O2,下列所述可以说明反应达到平衡状态的是
2NO+O2,下列所述可以说明反应达到平衡状态的是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变
A.①③ B.②④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法正确的是
A.在铁门上焊接铜块能防腐蚀
B.镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用
C.钢柱在水下部分比在空气与水交界处更容易腐蚀
D.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)2014年10月24日,我国探月工程三期再入返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空。火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C == K2S + N2 ↑+ 3CO2 ↑。
①写出该反应的氧化剂: ;K2S的电子式为 ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式: ;
实验二:取黑火药爆炸反应后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊(S)后又变澄清(SO42-)。请设计实验方案证明该澄清溶液中含有Cl-: ;
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵(NH4C1O4)、铝粉复合推进剂。高氯酸铵水溶液呈酸性的原因是 ;(用离子方程式表示)
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮;可燃物有肼(N2H4)、偏二甲肼等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,则它的分子式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
在水溶液中,YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y- + 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为
A.+4、6 B.+7、7 C.+5、7 D.+5、5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:实验题
(12分)某化学小组同学发现84消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。
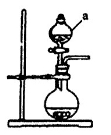
装置中仪器a的名称为 。
甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是 。
又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中c(CO32-):c(HCO3-)= 。
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。

①下列操作步骤的正确排序为 (填字母)。
a.体系冷却后,停止通入Cl2
b.通入干燥的Cl2赶尽装置中的空气
c.在铁屑下方加热至反应完成
d.用干燥的H2赶尽Cl2
e.检验装置的气密性
②该实验装置存在的明显缺陷是 。
(3)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
已知:NaCl+3H2O  NaClO3+3H2
NaClO3+3H2 ,2NaClO3+4HCl=2C1O2
,2NaClO3+4HCl=2C1O2 +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。
有关物质性质:
物质 | 熔点/℃ | 沸点/℃ |
C1O2 | -59 | 11 |
Cl2 | -107 | -34.6 |
ClO2的生产流程示意图:
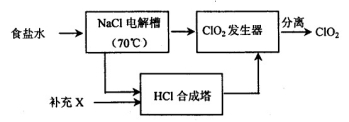
该工艺中,需要补充的物质X为 (填化学式),能参与循环的物质是 (填化学式)。从ClO2发生器中分离出ClO2可采用的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com