
| A. | 氯化钡、四氯化碳、硫酸、碘酒都属于化合物 | |
| B. | 硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、碱、盐、氧化物 | |
| C. | 溶液、浊液、胶体、空气都属于混合物 | |
| D. | CO2、SO2、P2O5、CO都属于酸性氧化物 |
分析 A、化合物是不同元素组成的纯净物;
B、根据酸指电离时产生的阳离子全部都是氢离子的化合物,碱指电离时产生的阴离子全部都是氢氧根离子的化合物,盐指电离时生成金属阳离子(或NH4)和酸根离子的化合物,氧化物是由两种元素组成,其中一种是氧元素进行书写;
C、混合物是不同物质组成的;
D、酸性氧化物是和碱反应生成盐和水的氧化物.
解答 解:A、氯化钡、四氯化碳、硫酸都属于化合物,但是碘酒属于混合物,故A错误;
B、硝酸、纯碱、磷酸钠、二氧化碳分别属于酸、盐、盐、氧化物,故B错误;
C、溶液、浊液、胶体、空气都是不同物质组成的,属于混合物,故C正确;
D、CO2、SO2、P2O5都属于酸性氧化物,但是CO不是,故D错误.
故选C.
点评 本题考查物质的类别,学生应熟悉物质类别的概念,利用概念来选择元素形成符合要求的相应的化合物.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
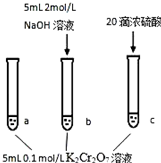 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
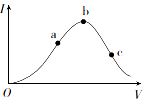 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 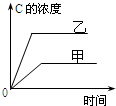 研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 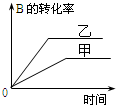 研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 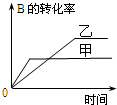 研究的是温度对反应的影响,且乙的温度较高 | |
| D. | 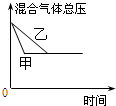 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com