
分析 (1)同温同压下,相同体积的气体的物质的量相等,含有相同分子数目,根据物质的量和气体的摩尔质量;
(2)根据n=$\frac{m}{M}$计算氧气物质的量,氧原子物质的量为氧气的2倍,结合N=nNA计算;
(3)二氧化碳的摩尔质量为44g/mol,二氧化碳的物质的量为$\frac{88g}{44g/mol}$=2mol,其标况下的气体体积为2mol×22.4L/mol=44.8L;
(4)已知1.2gRSO4中含0.01molR2+,则RSO4的物质的量为0.01mol,RSO4的摩尔质量是$\frac{1.2g}{0.01mol}$=120g/mol,由此求R的相对原子质量.
解答 解:(1)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
体积相同,则密度之比等于物质的质量之比,也为4:11,
故答案为:1:1;1:1;4:11;
(2)氧气物质的量为$\frac{ag}{32g/mol}$=$\frac{a}{32}$mol,氧原子物质的量为氧气的2倍,则N=$\frac{a}{32}$mol×2×NA,故NA=$\frac{16N}{a}$mol-1,故答案为:$\frac{16N}{a}$mol-1;
(3)二氧化碳的摩尔质量为44g/mol,二氧化碳的物质的量为$\frac{88g}{44g/mol}$=2mol,分子数为2NA,其标况下的气体体积为2mol×22.4L/mol=44.8L,故答案为:44g/mol;2mol;2NA;44.8L;
(4)已知1.2gRSO4中含0.01molR2+,则RSO4的物质的量为0.01mol,RSO4的摩尔质量是$\frac{1.2g}{0.01mol}$=120g/mol,R的相对原子质量是120-96=24,
故答案为:120g/mol;24.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式,难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  装置用于蒸馏石油 | |
| B. |  装置可用来分离乙醇和乙酸 | |
| C. |  装置可用于比较碳酸、苯酚酸性的强弱 | |
| D. |  装置可用于证明溴乙烷与NaOH乙醇溶液共热生成乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有的分子数为NA | |
| B. | 常温常压下,7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 将含lmol FeCl3的溶液制得的Fe(OH)3胶体中含胶粒数为NA(假设所有的FeCl3都转化为Fe(OH)3胶体) | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | >0.1摩/升 | B. | <0.1摩/升 | C. | =0.125摩/升 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X极为负极,Y极为正极 | |
| B. | 在标准状况下通入5.6LO2完全反应,则有0.5mol电子发生转移 | |
| C. | 工作一段时间后,KOH的物质的量减小 | |
| D. | 该电池工作时甲烷一极附近溶液pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
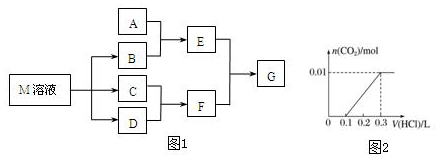
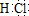
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量是16 g/mol | B. | Na+的摩尔质量是23 g/mol | ||
| C. | CO2的质量是44 g/mol | D. | 氢的摩尔质量是2 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、CO32- | B. | K+、NO3-、Cl- | ||
| C. | Na+、Fe3+、OH- | D. | Ba2+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏天混用不同品牌的墨水书写时,钢笔的笔尖容易发生堵塞是因为胶体发生了聚沉 | |
| B. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| C. | 实验室用托盘天平称量烧碱时,为防止腐蚀托盘,需在托盘上垫上小纸片 | |
| D. | 合金的硬度一般小于它的成分金属,熔点高于它的成分金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com