
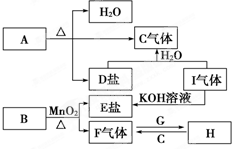
 ��֪A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������G��F�ǵ��ʣ������Ϊ�����H��һ�ֵ���ɫ���壬���ǵ�ת����ϵ��ͼ��ʾ����ش𣺣���ʾ��ʵ����������������������������[������]��ϼ�����ȡ��
��֪A��B��C��D��E��F��G��H��I�������ʣ�����A��B��D��E��ɫ��Ӧ��Ϊ��ɫ������ɫ�ܲ�������G��F�ǵ��ʣ������Ϊ�����H��һ�ֵ���ɫ���壬���ǵ�ת����ϵ��ͼ��ʾ����ش𣺣���ʾ��ʵ����������������������������[������]��ϼ�����ȡ��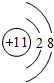 ���ʴ�Ϊ��
���ʴ�Ϊ��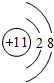 ��
��
| ||
| ||
| 4.2g��2mol |
| 56g |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��HCl |
| B��ϡK2SO4��Һ |
| C��FeCl3 |
| D��ϡNaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.2 mol Na+ |
| B��0.05 mol CO |
| C��6.02��1023�� O |
| D��0.1 mol H |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| X | Y | |
| A | ϡ���� | ̼������Һ |
| B | ƫ��������Һ | ������Һ |
| C | ������Һ | �Ȼ�����Һ |
| D | һˮ�ϰ� | �Ȼ�����Һ |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com