
【题目】某硫酸铝和硫酸镁的混合液中,c(Mg2+)=2mol/L,c(S042-)=6.5mol/L,若将100 mL的此混合液中的Mg2+和Al3+分离,至少应加入1.6mol/L的氢氧化钠溶液 ( )
A.1.0LB.0.5 LC.1.8LD.2L
【答案】A
【解析】
根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42),据此计算c(Al3+),进而溶液计算n(Al3+),要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为AlO2,需要的氢氧化钠的体积最小,此时溶液中溶质为硫酸钠、偏铝酸钠,根据钠元素守恒可知n(Na+)=2n(SO42)+n(AlO2),据此计算n(Na+),根据V=![]() 计算氢氧化钠的体积。
计算氢氧化钠的体积。
根据电荷守恒可知,原溶液中2c(Mg2+)+3c(Al3+)=2c(SO42),所以2×2mol/L+3c(Al3+)=2×6.5mol/L,所以c(Al3+)=3mol/L,所以原溶液中n(Al3+)=0.1L×3mol/L=0.3mol;要使原混合液中的Mg2+、Al3+分离,加入的氢氧化钠恰好使Mg2+转化为Mg(OH)2,Al3+转化为AlO2,需要的氢氧化钠的体积最小,此时溶液中溶质为硫酸钠、偏铝酸钠,根据钠元素守恒可知n(Na+)=2n(SO42)+n(AlO2)=2×0.1L×6.5mol/L+0.3mol=1.6mol,所以至少应加入1.6molL1氢氧化钠溶液的体积为![]() =1.0L;故答案选A。
=1.0L;故答案选A。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请回答以下问题。
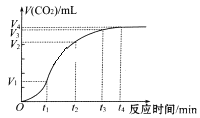
(1)化学反应速率最快的时间段是_________,原因是________________。
A.0~t1 B.t1-t2 C. t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有_________。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.通入HCl
(3)若盐酸溶液的体积是20mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)=________________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
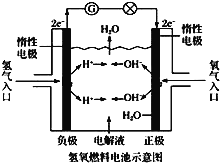
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.4.8g金属镁变为Mg2+时失去的电子数为0.2NA
B.6.2gNa2O中含有的阴离子数为0.1NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)![]() 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是:
A. 将容器体积变为10L,Z的平衡浓度变为原来的![]()
B. 在该温度下,该反应的平衡常数K=0.011
C. 达到平衡时,容器内气体的压强是原来的90%
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于______________
(2)B的平衡浓度为_____________
(3)A的转化率为____________
(4)生成D的反应速率______________
(5)如果增大反应体系的压强,则平衡体系中C的质量分数____________(填“增大”或“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+![]()
B.电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+![]() +5H2O=10H++2
+5H2O=10H++2![]() +8Cl-
+8Cl-
D.将0.2mol·L-1的NH4Al(SO4)2溶液与0.4mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是
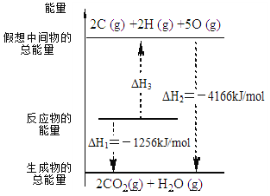
A.840B.1590C.900D.1250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图。请回答下列问题:
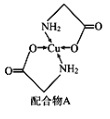
(1)写出基态Cu的外围电子排布式_____________________________________。
(2)配体氨基乙酸根(H2NCH2COOˉ)受热分解可产生CO2和N2,N2中σ键和π键数目之比是__________;N2O与CO2互为等电子体,则N2O的电子式为____________。
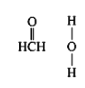
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醛分子中HCO的键角_____(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在如图中表示出来_____。
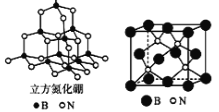
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;
(5)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为______。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com