
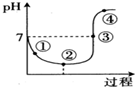
 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
分析 A、次氯酸不稳定;
B、①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4,所以Cl2(g)+H2O?HClO+H++Cl-,所以K=K1•K2;
C、③点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),由电子转移守恒c(Cl-)=c(ClO-)+c(HClO),联立计算判断;
D、PH值越小酸性越强,水的电离程度越小.
解答 解:A、次氯酸不稳定,所以冬季比夏季好,故A错误;
B、①Cl2(g)?Cl2(aq) K1=10-1.2
②Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4,所以Cl2(g)+H2O?HClO+H++Cl-,K=K1•K2=10-4.6,故B正确;
C、③点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),由电子转移守恒c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故C错误;
D、PH值越小酸性越强,水的电离程度越小,所以点②所示溶液中水的电离程度小于点①所示溶液中水的电离程度,故D错误;
故选B.
点评 本题综合考查氯气的性质,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 18gNH4+含有质子的数目为10NA | |
| B. | 1molNa2O2与足量CO2反应时,转移电子的数目为2NA | |
| C. | 标准状况下,体积均为22.4L的O2、HCl、H2O含有的分子数目均为NA | |
| D. | 质量为16g的O2和O3的混合气体中所含氧原子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| C. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| D. | 为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
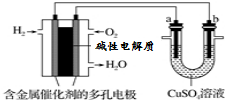
| A. | 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 | |
| B. | 若a为纯铜,b为粗铜,该装置可用于粗铜的电解精炼 | |
| C. | 燃料电池中正极反应为O2+4e-+2H2O=4OH- | |
| D. | 电子经导线流入b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
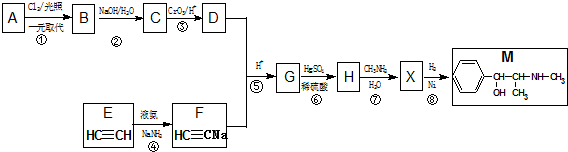
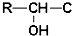 ≡C-R′
≡C-R′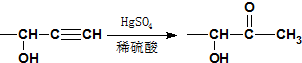
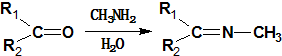
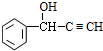 .
. +CH3NH2$\stackrel{水}{→}$
+CH3NH2$\stackrel{水}{→}$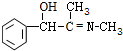 +H2O.
+H2O.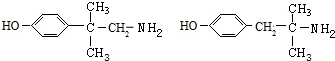 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
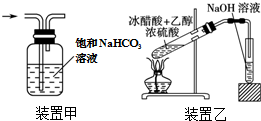
| A. | 将25.0gCuSO4•5H2O溶于100mL蒸馏水,配得1.0mol•L-1硫酸铜溶液 | |
| B. | 焰色反应实验中,在蘸取待测溶液前,先用稀盐酸洗净铂丝并灼烧至火焰为无色 | |
| C. | 用装置甲除去Cl2中的HCl气体 | |
| D. | 用装置乙制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
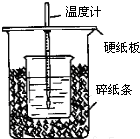 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com