
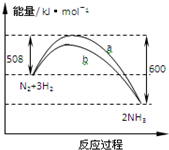
| A. | 1 mo N2与3 mo H2反应可以放出92 kJ的热量 | |
| B. | b曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该反应的焓变减小 | |
| D. | 正反应的活化能等于逆反应的活化能 |
分析 A.△H=放出的能量-吸收的能量;
B.催化剂能降低反应的活化能;
C.焓变与反应的始态和终态有关,与反应的途径无关;
D.正反应的活化能小于逆反应的活化能.
解答 解:A.△H=放出的能量-吸收的能量=508KJ/mol-600KJ/mol=-92KJ/mol,但是该反应为可逆反应,1 mo N2与3 mo H2反应不能全部转化为1mol氨气,所以放出的热量小于92 kJ,故A错误;
B.催化剂能降低反应的活化能,所以b曲线是加入催化剂时的能量变化曲线,故B正确;
C.焓变与反应的始态和终态有关,与反应的途径无关,所以加入催化剂,反应的路径改变,但是该反应的焓变不变,故C错误;
D.由图象可知,正反应的活化能小于逆反应的活化能,故D错误.
故选B.
点评 本题考查了化学反应中能量转化与催化剂的关系,热化学方程式的书写,图象的应用能力,难度不大,注意化学平衡的特征是可逆反应.


科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 爆炸力极强的N5变成N2是化学变化 | |
| B. | 水晶、玛瑙、钻石的主要成分均为SiO2 | |
| C. | NaCl溶液和Fe(OH)3胶体可以用过滤的方法分离 | |
| D. | 向鸡蛋清溶液中加入(NH4)2SO4或CuSO4均有鸡蛋清析出,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积为11.2L | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的氯化镁溶液中,含有氯离子个数为NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金的熔点介于钠、铝之间 | |
| B. | 钠或铝形成的氧化物均为碱性氧化物 | |
| C. | 等质量钠和铝分别与足量的盐酸反应钠产生的气体多 | |
| D. | 若合金中n(Na)=n(Al),将其投入到足量的水中,可得无色透明溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1的装置可用于比较MnO2、Cl2、S的氧化性 | |
| B. | 图2可知:30℃时Ca(OH)2溶液的浓度一定大于60℃时的温度 | |
| C. | 图3的装置可用于已知浓度的H2C2O4溶液测定未知浓度的NaOH溶液 | |
| D. | 图4的实验现象:酸性高锰酸钾溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com