
����Ŀ���л���ѧ����]MΪ�ϳɸ߷��Ӳ��ϵ��м��壬�Է�����A�Ʊ�M�߷��ӻ�����N��һ�ֺϳ�·�����£�

��֪��
��ش��������⣺
��1��C�Ļ�ѧ����Ϊ________��
��2��A��B��H��M�ķ�Ӧ���ͷֱ�Ϊ________��________��
��3��F�����������ŵ�����Ϊ________��G�Ľṹ��ʽΪ________��
��4���Լ�1Ϊ________��
��5��D��N�Ļ�ѧ����ʽΪ________��
��6��QΪH��ͬ���칹�壬ͬʱ��������������Q�Ľṹ��ʽΪ________��
�ٱ�������������ȡ����������������������״�ṹ
�������Ȼ�����Һ������ɫ��Ӧ��1 mol Q�������3 molNaOH
�ۺ˴Ź���������5��壬�����֮��Ϊ6��2��2��1��1
��7�����������ϳ�·�ߺ���Ϣ���Լ�ȩ����ȩΪ��ʼԭ�ϣ����Լ���ѡ��������Ʊ��۱�ϩ�ᣨ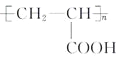 ���ĺϳ�·�ߣ�________��
���ĺϳ�·�ߣ�________��
���𰸡����� ȡ����Ӧ ������Ӧ����ȡ����Ӧ�� ȩ�����Ѽ� ![]() ������Һ[������Cu��OH��2����Һ]
������Һ[������Cu��OH��2����Һ] 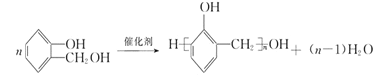
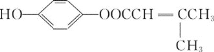 CH3CHO
CH3CHO ![]() CH2��CHCHO
CH2��CHCHO

��������
���E�Ľṹ��ʽ����֪��D��CH3CH2I����ȡ����Ӧ����E��HI������֪DΪ![]() ��D�������۷�Ӧ���ɸ߷��ӻ�����N��C���ȩ�������Ϸ�Ӧ����D�����C�ķ���ʽ��֪CΪ���ӣ�BΪ�ȱ���AΪ����E����������Ӧ����FΪ
��D�������۷�Ӧ���ɸ߷��ӻ�����N��C���ȩ�������Ϸ�Ӧ����D�����C�ķ���ʽ��֪CΪ���ӣ�BΪ�ȱ���AΪ����E����������Ӧ����FΪ![]() ��
��![]() ������������Һ������ȩ����������֪��Ӧ���͵ķ�Ӧ������GΪ
������������Һ������ȩ����������֪��Ӧ���͵ķ�Ӧ������GΪ![]() ��H���Ҵ���Ũ������·���������Ӧ����M������M�Ľṹ��ʽ����֪HΪ
��H���Ҵ���Ũ������·���������Ӧ����M������M�Ľṹ��ʽ����֪HΪ![]() ��
��
��1��C�Ļ�ѧ����Ϊ������
��2��A��B�DZ����Ȼ����Ĵ�������������ȡ����Ӧ�����ȱ����Ȼ��⡢H��M��![]() ���Ҵ���Ũ����Ĵ��·���������Ӧ��Ҳ����ȡ����Ӧ������M��ˮ����Ӧ���ͷֱ�Ϊȡ����Ӧ��������Ӧ����ȡ����Ӧ����
���Ҵ���Ũ����Ĵ��·���������Ӧ��Ҳ����ȡ����Ӧ������M��ˮ����Ӧ���ͷֱ�Ϊȡ����Ӧ��������Ӧ����ȡ����Ӧ����
��3��FΪ![]() �����������ŵ�����Ϊȩ�����Ѽ���G�Ľṹ��ʽΪ
�����������ŵ�����Ϊȩ�����Ѽ���G�Ľṹ��ʽΪ![]() ��
��
��4���Լ�1��G�е�ȩ������Ϊ�Ȼ���Ϊ������Һ[������Cu��OH��2����Һ]��
��5��D��N��![]() �ڴ��������·������۷�Ӧ����
�ڴ��������·������۷�Ӧ����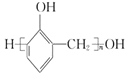 ��ˮ����Ӧ�Ļ�ѧ����ʽΪ
��ˮ����Ӧ�Ļ�ѧ����ʽΪ ��
��
��6��QΪH��ͬ���칹�壬����ٱ�������������ȡ����������������������״�ṹ���������Ȼ�����Һ������ɫ��Ӧ���з��ǻ���1 mol Q�������3 molNaOH��������ԭ�Ӹ�����֪Ӧ�û�����һ�������ڱ����ϵ�������ˮ��������������ǻ����ۺ˴Ź���������5��壬�����֮��Ϊ6��2��2��1��1�����������⣬������������������������ͬ���칹��Ϊ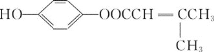 ��
��
��7�����������ϳ�·�ߺ���Ϣ����ȩ����ȩ������������Һ�м��ȷ�Ӧ����CH2��CHCHO��CH2��CHCHO��������Һ��ˮԡ���ȷ���������Ӧ���ữ�õ�CH2��CHCOOH��CH2��CHCOOH�ڴ��������·����Ӿ۷�Ӧ���ɾ۱�ϩ�ᣬ���Ʊ��۱�ϩ�ᣨ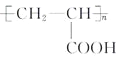 ���ĺϳ�·��Ϊ�� CH3CHO
���ĺϳ�·��Ϊ�� CH3CHO ![]() CH2��CHCHO
CH2��CHCHO



 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A���֣����Ӣɰ(ZrO2��SiO2����������Fe2O3��Al2O3��SiO2������)�Ʊ�ZrO2���������£�

��֪����ZrO2��ǿ������Һ����ZrO32-��ʽ���ڣ���ǿ������Һ����ZrO2+��ʽ���ڡ�
�ڲ��ֽ���������ʵ�������¿�ʼ��������ȫ������pH���±���
Mn+ | Fe3+ | Al3+ | ZrO2+ |
��ʼ����ʱpH | 1.9 | 3.3 | 6.2 |
������ȫʱpH | 3.8 | 5.6 | 8.0 |
(1)����I����Ҫ�IJ�������Ϊ___________������I���˵õ���Һa���ɵõ�_________��
(2)�Ӱ�ˮ����Һa�е���pH�ĵķ�Χ��________________��
(3)����II��õ���Һb������II������II����������£�
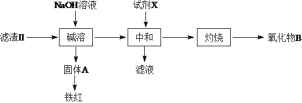
������B�Ļ�ѧʽΪ__________�����Լ�XΪ���ᣬȱ����___________��
(4)����III���õ�Zr(OH)4��õ�ij����Һ�������Һ�м���CaCO3��ĩ�����ȣ��õ��������塣�÷�Ӧ�����ӷ���ʽΪ_____________________________��
(5)���백ˮ����Һb���������ӷ���ʽΪ__________________________��
(6)Ϊ�õ�������ZrO2��Zr(OH)4��Ҫϴ�ӣ�����Zr(OH)4�Ƿ�ϴ�Ӹɾ��ķ�����______________��
B���֣��Ѿ����Ǵ���������Ѵ������в�ѡ��������Ҫ�ɷ�ΪFeTiO3����������;�dz��㷺���Ѱ۵�ԭ�ϡ����Ѿ���ʯΪԭ���Ʊ������ѵ���������ͼ��ʾ(ijЩ���˹����Ѻ���)����֪ǿ������Һ�У�+4�۵���Ԫ����TiO2+��ʽ���ڣ������Ѳ�����ϡ���������ᡣ�ش��������⣺

(1)�����������������__________________��
(2)����K�׳��̷�������K�Ļ�ѧʽΪ____________��
(3)��д����ҺC�����Ʊ���������Ļ�ѧ����ʽ__________________________________��
(4)�����������Ļ���̿�������Ļ�ѧ����ʽΪ_______________����֪TiO2+2Cl2![]() TiCl4+O2Ϊ���ȷ�Ӧ���Ҹ������·�ӦҲ�ܹ�������Ϊ���Ʊ�TiCl4�����л�Ҫ�������̿���Խ���ԭ��_________________��
TiCl4+O2Ϊ���ȷ�Ӧ���Ҹ������·�ӦҲ�ܹ�������Ϊ���Ʊ�TiCl4�����л�Ҫ�������̿���Խ���ԭ��_________________��
(5)����F�����F��������_____________________��
(6)��ҺH��_________������Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ�����Ļ����Ͷ��100ml�����У�����ȫ���ܽ����������Һ�м���NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ�������ϵ��ͼ��ʾ��
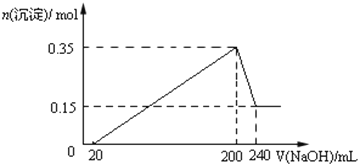
��1��ԭ�������þ������������Ϊ_______
��2��NaOH��Һ�����ʵ���Ũ��Ϊ_______ molL��1
��3�����ɵ������ڱ�״���µ����Ϊ_______ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ��ˮ��ɫ����
A.ʯ�ͷ��ֲ���������
B.ʯ���ѻ�����������
C.�����廯ʱ����������
D.�Ҵ���Ũ���ᷴӦ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۴�����ϩ�����ϼ���Ӧ�ù㷺�������Ǹ��л���ĺϳ�·�ߣ�
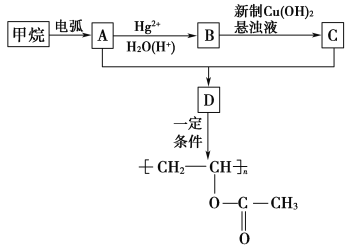
��ʾ���������ڵ绡������������Ȳ����
��CH3C��CH![]() CH3CH2CHO(δ��ƽ)��
CH3CH2CHO(δ��ƽ)��
��ش��������⣺
(1)����ϳ�A�Ļ�ѧ��Ӧ��ԭ��������Ϊ________��
(2)B�Ľṹ��ʽΪ________��
(3)B����C�ķ�Ӧ�г�����Cu(OH)2����Һ���Ҫ��������________��
(4)A��C��Ӧ����D�ķ�Ӧ������________��
(5)д����D����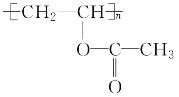 ��Ӧ�Ļ�ѧ����ʽ��________________________________��
��Ӧ�Ļ�ѧ����ʽ��________________________________��
(6)д����ʹ��ɫʯ����Һ����D������ͬ���칹��Ľṹ��ʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ũ�ȵ�FeSO4��(NH4)2SO4����Ũ��Һ��Ͽ��Ƶ�һ�־��壬�þ���(��Ħ����)�Ƿ�����ѧ�г��õ�һ�ֻ�ԭ������ǿ�ȷֽⷴӦ��ѧ����ʽ��2(NH4)2Fe(SO4)2��6H2O![]() Fe2O3+2NH3��+N2��+4SO2��+17H2O������˵����ȷ����( )
Fe2O3+2NH3��+N2��+4SO2��+17H2O������˵����ȷ����( )
A. �÷�Ӧ������������N2��NH3����ԭ������SO2��Fe2O3
B. 1molĦ����ǿ�ȷֽ�ʱת�Ƶ��ӵ����ʵ���Ϊ8NA
C. ��Ħ������Һ�е�������ŨNaOH��Һ�����տɵô̼�������ͺ��ɫ����
D. �����£�Ħ���ε��ܽ�ȱ�FeSO4��(NH4)2SO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý�������ʵ�飬ʵ������Ԥ���������һ�����ǣ� ��
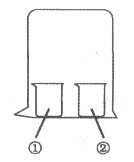
���е����� | ���е����� | Ԥ��ٵ����� | |
A | ����KI��Һ | Ũ���� | �����Ա仯 |
B | ��̪��Һ | Ũ���� | �����Ա仯 |
C | MgCl2��Һ | Ũ��ˮ | �а�ɫ���� |
D | ʪ���ֽ�� | ������ˮ | ��ֽ����ɫ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ʵ����۾���ȷ����
ʵ����� | ʵ����� | |
A | �ȼ�������ˮ���ٵμ�KSCN��Һ������Ѫ��ɫ | ֤��ij��Һ�д���Fe2�� |
B | ��AgCl����Һ�м���NaI��Һʱ���ֻ�ɫ���� | Ksp(AgCl)<Ksp(AgI) |
C | ��̼����еμ����ᣬ�����ݲ��� | ֤���ȵķǽ����Դ���̼ |
D | ��MgCl2��Һ���Ȼ�����������������ᾧ������ | �Ʊ��Ȼ�þ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ�� R��X��Y��Z��E��ԭ�������������ӣ����ǵĽṹ�Ͳ�����Ϣ���±���ʾ��
Ԫ�ش��� | ������Ϣ |
R | ��̬Rԭ�Ӻ����������ܼ���ÿ���ܼ��ϵ�������ͬ |
X | X��˫ԭ�ӵ��ʦļ��ͦм���Ŀ֮��Ϊ1��2 |
Y | ����������Ԫ���У�ԭ�Ӱ뾶��� |
Z | Z����������ϼ���������ϼ�֮�͵���4 |
E | ��̬E3+����Χ�����Ų�ʽ��3d5 |
�ش����⣺
��1��EԪ�������ڱ��е�λ����________�����̬ԭ���е���ռ�ݵ�����ܲ���__________________��
��2��Ԫ�� X���⻯��M�������ں�18�����ӣ�M�ĽṹʽΪ_____��ÿ������ԭ�ӵļ۲���Ӷ�����_________________��
��3����R��X��Z�ĺ�����������У���Ϊ�ȵ��������������_________________��
��4��ZԪ�ص������������Ӧ��ˮ�����У����Խ�ǿ��________����ԭ����_________________��
��5��(ZX)4�ڳ�ѹ�£�����130��ʱ(ZX)4�ֽ�Ϊ��Ӧ�ĵ��ʣ���һ�仯�ƻ�����������________________����Ϊ��ɫ�Թ��壬����ɫ��ЧӦ������-30��ʱΪ����ɫ������100��ʱΪ���ɫ.
�ڵ���ɫ���Ȼ�ɫ�����ɫ��ת���У��ƻ�����������_________________��
��6�����������£�E�ľ��������ͼ��ʾ�Ķѻ���ʽ�������ֶѻ�ģ�͵���λ��Ϊ__________����Eԭ�ӵİ뾶Ϊr������E��ԭ�ӿռ�������Ϊ________________�����г�����ʽ���ɣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com