
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
分析 A.以含硅物质为原料经加热制成的产品,通常称为硅酸盐产品.所谓硅酸盐指的是硅、氧与其它化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称;
B.水玻璃是硅酸钠的水溶液,是一种矿物胶;
C.高纯度的硅被用于制作太阳能电池板,半导体等,光导纤维成分为二氧化硅;
D.石英晶体(结晶的二氧化硅)中无色透明的晶体是水晶,石英主要成分为二氧化硅.
解答 解:A.水泥制备是以粘土、石灰石为原料制备得到得硅酸盐,陶瓷以粘土为原料制备得到主要成分为硅酸盐,玻璃是以纯碱、石灰石、石英为原料生产得到的硅酸盐,产物的主要成分都含硅酸盐,是三大重要的硅酸盐产品,故A正确;
B.水玻璃的主要成分为硅酸钠,具有黏性,可用作粘合剂,故B正确;
C.晶体硅可导电,可用于制作太阳能电池板、半导体材料,二氧化硅是光导纤维的成分,故C错误;
D.石英晶体(结晶的二氧化硅)中无色透明的晶体是水晶,为二氧化硅晶体,石英的主要成分为二氧化硅,故D正确;
故选C.
点评 本题考查硅及其化合物的性质与用途,比较基础,注意知识的识记掌握,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴单质 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铝陶瓷和光导纤维都是无机非金属材料 | |
| B. | 硫、氮、碳的氧化物是形成酸雨的主要物质 | |
| C. | 使用氢能源替代化石燃料可减少CO2排放 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸氢钠与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
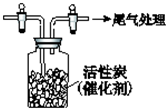 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:
实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
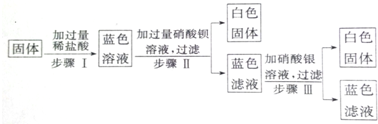
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com