
| A. | HCO3-→CO32- | B. | MnO2→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |
科目:高中化学 来源: 题型:选择题
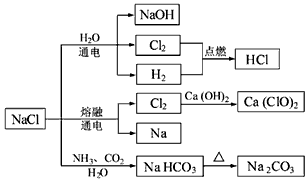
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 | |
| C. | 石英玻璃耐强酸强碱,高温下可用来熔融氢氧化钠 | |
| D. | Na2SiO3是制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com