
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。

①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
【答案】4SO2+3CH4 4H2S+3CO2+2H2O H2S
4H2S+3CO2+2H2O H2S![]() H++HS- 8.0×10-3mol·L-1 1076 增大 反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大 20% 0.044
H++HS- 8.0×10-3mol·L-1 1076 增大 反应ⅰ为吸热反应,升高温度,平衡正向移动,CO的平衡体积分数增大;反应ⅱ为放热反应,升高温度,平衡逆向移动,CO的平衡体积分数也增大 20% 0.044
【解析】
I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S;
II.(2)H2S的第一步电离产生H+和HS-,是不完全电离;
(3)根据溶度积常数计算;
III.(4)根据盖斯定律计算,△H=反应物总键能-生成物总键能;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,根据方程式计算COS的平衡转化率,将各组分平衡浓度代入平衡常数表达式计算反应i的平衡常数。
I.(1)工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物,从元素角度考虑,这两种氧化物为CO2和H2O,反应产生H2S,则该反应的化学方程式为:4SO2+3CH4═4H2S+3CO2+2H2O;
II.(2)H2S的第一步电离产生H+和HS-,是不完全电离,则H2S的第一步电离方程式为:H2SH++HS-;
(3)向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(S2-)= =
=![]() =1.0×10-24mol/L,则溶液中c(Cd2+)=
=1.0×10-24mol/L,则溶液中c(Cd2+)= =
=![]() =8.0×10-3mol/L;
=8.0×10-3mol/L;
III.(4)根据反应i:COS(g)+H2(g)H2S(g)+CO(g)△H=+7kJ/mol,根据盖斯定律,△H=1319+442-678-x=7,可得x=1076;
(5)①根据方程式和图象分析,升高温度,CO的平衡体积分数增大,升高温度使化学反应平衡向吸热方向进行,反应i为吸热反应,升高温度,化学平衡向正反应方向进行,CO的体积分数增大,反应ii为放热反应,升高温度化学平衡向逆反应方向移动,CO的体积分数增大,综合两个反应考虑,CO的体积分数随着温度升高而增大;
②T1℃时,测得平衡时体系中COS的物质的量为0.80mol,此时CO的平衡体积分数为5%,反应起始时,向10L容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),则COS的平衡转化率为α=![]() ×100%=20%;
×100%=20%;
反应i的方程式:COS(g)+H2(g)H2S(g)+CO(g),
起始(mol) 1 1 0 0
转化(mol) 0.2 0.2 0.2 0.2
平衡(mol) 0.8 0.8 0.2 0.2
反应ii的方程式:CO(g)+H2O(g)CO2(g)+H2(g)
起始(mol) 0.2 1 0 0.8
转化(mol) x x x x
平衡(mol) 0.2-x 1-x x 0.8+x
CO的平衡体积分数为5%,则0.2-x=3×5%,可得x=0.05,则平衡时c(COS)=![]() =0.08mol/L,c(H2)=
=0.08mol/L,c(H2)=![]() mol/L=0.085mol/L,c(H2S)=
mol/L=0.085mol/L,c(H2S)=![]() =0.02mol/L,c(CO)=
=0.02mol/L,c(CO)=![]() mol/L=0.015mol/L,因此反应i的化学平衡常数为K1=
mol/L=0.015mol/L,因此反应i的化学平衡常数为K1=![]() =
=![]() =0.044。
=0.044。


科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是
A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D
C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
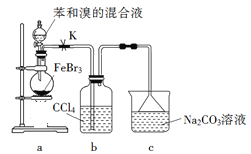
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.惰性电极电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.钢铁吸氧腐蚀中的正极反应:4OH-- 4e-=2H2O+O2 ↑
C.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数36.5%的浓盐酸配制0.1mol·L-1的盐酸240mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为_______。
(2)配制240 mL0.1mol·L-1的盐酸应选用_______mL的容量瓶,需要量取浓盐酸体积为_______mL。
(3)定容时,除了烧杯、玻璃棒、容量瓶外,还需要的玻璃仪器是_______。
(4)正确的操作顺序是________(填序号)
①用胶头滴管逐滴加水,使溶液凹液面恰好与容量瓶刻度线相切
②向容量瓶中加水至液面接近瓶颈上的刻度线1-2cm处
③根据计算,用量筒称取一定体积的浓盐酸
④将容量瓶盖紧,振荡,摇匀
⑤将浓盐酸倒入烧杯中加水稀释,并不断用玻璃棒搅拌,静置待其冷却
⑥将溶液用玻璃棒引流注入查漏过的容量瓶中
⑦少量水洗涤烧杯及玻璃棒2至3次,并将每次的洗涤液也注入容量瓶中
(5)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度_________;
②定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1B.0.2mol·L-1C.0.4mol·L-1D.0.8mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com