
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
分析 A.pH=1的溶液,显酸性;
B.离子之间相互促进水解;
C.离子之间发生氧化还原反应,离子之间结合生成络离子;
D.pH=12的溶液,显碱性.
解答 解:A.pH=1的溶液,显酸性,不能大量存在HCO3-,故A错误;
B.Al3+、CO32-相互促进水解,不能大量共存,故B错误;
C.Fe3+、I-发生氧化还原反应,Fe3+、SCN-结合生成络离子,不能大量共存,故C错误;
D.pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的发生,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
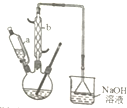 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O22-与S2-具有相同的质子数和电子数 | |
| B. | H、D、T互为同位素,H2O、D2O、T2O互为同素异形体 | |
| C. | 碱金属元素是指 IA族的所有元素 | |
| D. | 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
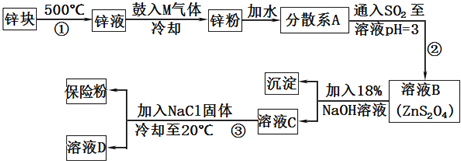
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com