
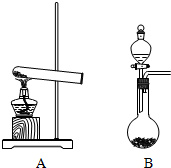
 如图,实验室制取氨气有几种方法,
如图,实验室制取氨气有几种方法,分析 (1)依据反应物状态和反应条件分析判断制备气体的装置,反应是固体氯化铵和氢氧化钙加热反应生成氨气;A装置属于固固混合加热装置,B装置属于固液混合不加热型装置,从化学平衡及固体NaOH的性质角度分析选择装置;
(2)氨气的密度比空气小;
(3)依据氨气溶于水呈碱性,以及氨气和氯化氢生成白烟证明;
(4)氨气是碱性气体,用碱性干燥剂干燥,碱石灰是碱性干燥剂.
解答 解:(1)①A装置属于固固混合加热装置,用NH4Cl和Ca(OH)2来制取氨气,反应物是固体和固体加热制备气体的反应,选用大试管加热制备氨气,选则装置A,用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:A;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②NaOH溶于水放出热量,故致使溶于水的氨气溶解度降低,从而逸出,氨水为弱电解质存在电离平衡:NH3+H2O?NH3•H2O?NH4++OH-,加入氢氧化钠,氢氧根浓度增大,平衡左移,氨气逸出,B装置属于固液混合不加热型装置,当用浓氨水和NaOH固体来制取氨气时应选用装置B,
故答案为:B;
(2)氨气密度比空气轻,易溶于水,用向下排空气法收集;
故答案为:向下排空气;
(3)检验氨气是否已经收集满的方法,依据氨气溶于水呈碱性,将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝.或把沾有酚酞试液的滤纸片放在离管口很近的地方,观察是否变色,氨气和氯化氢反应生成氯化铵,现象为生成白烟,所以或把蘸有浓盐酸的玻璃棒靠近试管口,看是否有白烟生成,
故答案为:将湿润的红色石蕊试纸靠近试管口,看试纸是否变蓝.或把沾有酚酞试液的滤纸片放在离管口很近的地方,观察是否变色.或把蘸有浓盐酸的玻璃棒靠近试管口,看是否有白烟生成;
(4)干燥氨气需要选择碱性干燥剂;
A、碱石灰是碱性干燥剂可以干燥氨气,故A符合;
B、浓H2SO4和氨气反应,不能用来干燥氨气,故B不符合;
C、无水CaCl2和氨气反应生成络合物,不能干燥氨气,故C不符合;
D、P2O5和水反应生成磷酸可以吸收氨气,不能干燥氨气,故D不符合;
故答案为:A.
点评 本题考查了实验室氨气的制备装置和试剂选择,反应原理的分析判断,掌握基础是解题关键,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和CO2属于分子晶体 | |
| B. | CO2和CH4分子中含有极性共价键,但都是非极性分子 | |
| C. | 因为碳氢键键能小于碳氧双键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 .
.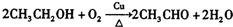 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
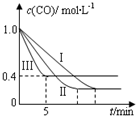 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com