
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图(未表示出其空间构型).下列关于普伐他汀的描述正确的是( )

A.分子中含有3种官能团
B.可发生加成反应、氧化反应
C.在水溶液中羧基和羟基均能电离出H+
D.1mol该物质最多可与1mol NaOH反应
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】实验式相同,既不是同系物,又不是同分异构体的是( )
A.1-辛烯和3-甲基-1-丁烯 B.苯和乙炔
C.1-氯丙烷和2-氯丙烷 D.甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
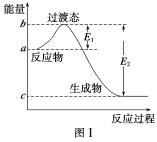
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。
(2)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
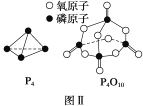
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=___ _____ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质
已知A、B、C、D、E、F为元素周期表前四周期原子序数依次增大的六种元素。其中A的核外电子总数与其周期数相等,B原子核外有三个能级,每个能级上的电子数相同。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)元素F基态原子价层电子排布式为____________。
(2)B、C、D第一电离能由小到大的顺序为______________。(用元素符号表示)
(3)A与其它元素形成的二元共价化合物中,分子呈三角锥形,该分子的电子式为 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有 (写出其中两种的化学式)。
(4)BE2分子中,按原子轨道的重叠方式的不同存在的共价键类型有 ;B原子的杂化轨道类型为 ;写出两种与BE2互为等电子体的分子或离子 。
(5)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为______________,F原子配位数之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0
B. 镀锌铁制品镀层受损后,铁制品比受损前更容易生锈
C. 生铁中含有碳,抗腐蚀能力比纯铁强
D. Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途不正确的是
A. 高纯度的单质硅可用于制作计算机芯片 B. 钠钾合金可在快中子反应堆中作热交换剂
C. 二氧化硫不可用作熏蒸粉丝 D. 碳酸钠可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构、性质的分析正确的是
A. 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同
B. 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键
C. 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化
D. 乙醇在铜催化作用下,能发生还原反应生成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选修3——物质结构与性质]
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为: I1=578KJ·mol-1 I2=1817KJ·mol-1 I3=2745KJ·mol-1 I4=11575KJ·mol-1 I5=14830KJ·mol-1 I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子的电子排布式为_____________,其第一电离能比Z元素原子的第一电离能________(填“高”或“低”)
(2)X的氯化物的熔点比Q的氯化物的熔点_______________(填“高”或“低”),理由是___________________
(3)光谱证实元素W的单质与强碱性溶液反应有W(OH)4]-生成,则W(OH)4]-中存在_______(填字母)
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_________;晶体中每个镁原子周围距离最近的R原子有___________个。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com