
| A. | 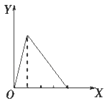 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| B. | 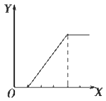 向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡W | |
| C. |  向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量8 | |
| D. | 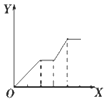 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
分析 A.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡,先产生氢氧化铝沉淀,后沉淀溶解,且产生沉淀,和沉淀溶解消耗盐酸的比为1:3;
B.向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡,开始无沉淀,后产生沉淀;
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,先产生氢氧化铝沉淀,然后沉淀量不变,最后沉淀溶解,且消耗NaOH的比为3:1:1;
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,产生沉淀,沉淀的量不变,又产生沉淀,沉淀量不变,最后沉淀部分溶解.
解答 解:A.向NaAlO2溶液中滴加稀盐酸,开始阶段先产生氢氧化铝沉淀,发生反应:AlO2-+H++H2O=Al(OH)3↓,随着盐酸的逐滴加入,则沉淀开始溶解,发生反应Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3,故A正确;
B.向NaHSO4溶液中逐滴加入KAlO2溶液至过量且边滴边振荡,开始无沉淀,发生反应:AlO2-+4H+=Al3++2H2O,随着KAlO2溶液的逐滴加入,则沉淀开始生成,发生反应:3AlO2-+Al3++6H2O=4Al(OH)3↓,所以开始无沉淀消耗的KAlO2溶液和沉淀量达到最大消耗的KAlO2溶液的物质的量之比是1:3,故B正确;
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3•H2O;NH4+,此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH,沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;故C正确;
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,先发生反应Ba(OH)2+CO2=BaCO3↓+H2O,产生沉淀,然后发生反应:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,后再发生反应:CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2,沉淀部分溶解,故D错误;
故选:D.
点评 本题考查化学反应与图象的关系,解答本题关键在于理解相关反应和反应的顺序,并要求能够熟练写出相应的反应的方程式,找出对应的图形即可,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.4 | C. | 0.3 | D. | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| B. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| C. | 用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 | |
| D. | 用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | 预测的现象 | 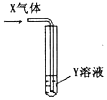 | |
| ① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
| ② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
| ③ | NH3 | AgNO3溶液 | 白色沉淀析出 | |
| ④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中Ca CO3+2 H+═H2O+CO2↑+Ca2+ | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2 H+═Ca2++2 H2O | |
| C. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O | |
| D. | 氢氧化镁与盐酸的反应OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com