
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
分析 (1)根据硫酸和氢氧化钠恰好反应,二者的关系H2SO4~2NaOH求出硫酸的浓度,氢氧化钠的体积取平均值,考虑到第三次误差较大,应舍去;
(2)根据操作对c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$的影响进行分析误差.
解答 解:(1)氢氧化钠的体积第三次误差较大,应舍去,其余3次的平均体积为:(18.30+18.10+18.20)mL÷3=18.20mL,硫酸和氢氧化钠恰好反应的关系:
H2SO4~2NaOH,则硫酸的物质的量为:$\frac{1}{2}$×18.20×10-3L×0.20mol/L=1.82×10-3mol,浓度c=$\frac{n}{V}$=$\frac{1.82×1{0}^{-3}mol}{20.00×1{0}^{-3}L}$=0.091mol/L,
故答案为:0.091;
(2)根据c(H2SO4)=$\frac{c(NaOH)×V(NaOH)}{2V({H}_{2}S{O}_{4})}$分析:
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质,导致所用氢氧化钠溶液体积偏大,造成测定结果偏高,故A偏高;
B.滴定终点读数时,俯视滴定管的刻度,其读数偏少,V(NaOH)偏少,故B偏低;
C.滴定管在滴定前尖嘴处有气泡,滴定后消失,V(NaOH)偏高,故C偏高;
D.实验目的是中和已定量的硫酸,与锥形瓶中水的多少无关,所以盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,对实验无影响,故D无影响;
E.未用标准液润洗碱式滴定管,氢氧化钠浓度降低,导致所用氢氧化钠体积增多,故E偏高;
故答案为:B.
点评 本题考查中和滴定量实验,明确实验原理和判断错误操作导致消耗标准液体积的影响是解题关键,注意在计算所用标准溶液的体积时,把不合理的数据去掉,剩余数据取平均值,题目难度中等.


科目:高中化学 来源: 题型:解答题
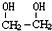 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol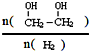 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
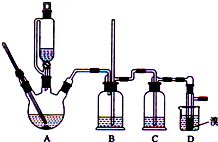 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
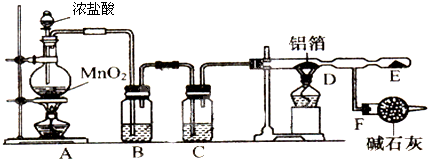
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量CO2反应转移的电子的物质的量为0.1mol | |
| B. | 将Na2O2粉末加入到饱和NaOH溶液中,OH-离子浓度一定不变 | |
| C. | 等物质的量的Na2O2与Na2O溶于等质量水中得到的NaOH的物质的量浓度相同 | |
| D. | 等质量的Na2O2与Na2S晶体中含有相同数目的阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com