
【题目】下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2、NH4ClB.NH3、H2O、CO2
C.N2、Na2O、CS2D.CaCl2、NaOH、H2O2
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】某小组研究铁与水蒸气的反应,两位同学分别进行了如下实验。
实验Ⅰ | 实验Ⅱ |
|
|
请回答:
(1)实验Ⅰ中湿棉花的作用是______________。
(2)实验Ⅰ中反应的化学方程式是__________。
(3)甲同学观察到实验Ⅰ中持续产生肥皂泡,实验Ⅱ中溶液B呈现红色。说明溶液A中含有___________。
(4)乙同学观察到实验Ⅰ中持续产生肥皂泡,但实验Ⅱ中溶液B未呈现红色。溶液B未呈现红色的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述正确的是( )
A.钠在空气中燃烧,发出淡蓝色的火焰,生成淡黄色固体
B.硅能导电,可用作光导纤维
C.玻璃花瓶和餐桌上的瓷盘都是硅酸盐产品
D.久置的氯水与新制的氯水,都能使有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,下列说法正确的是

A. 实验①可观察到红色喷泉
B. 实验②可收集到少量氨气
C. 实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D. 实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
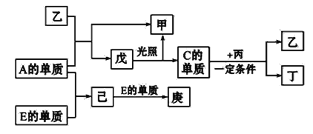
请回答下列问题:
(1)A在元素周期表中的位置:__________ ,写出实验室制取A的单质的离子反应方程式____________。
(2)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式________________。
(3)C的单质与丙反应的化学方程式为______________________________。
(4)F为短周期元素,与C同主族,向己的溶液中通入FC2气体,发生反应的离子反应方程式为:_________________________________________ 。
(5)氟元素的非金属性比D元素强,用原子结构的知识解释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2-都能与MnO反应生成NO3-和Mn2+,如5NO2-+2MnO4-+6H+===5NO3-+2Mn2++3H2O。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:

(1)A中观察到的现象是_________________________________。
(2)B中反应的离子方程式是____________________,_______________________。
(3)装置C的作用是___________________,装置F的作用是__________________。
(4)若无装置D,则E中产物除亚硝酸钠外,还有副产物________(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
(提出假设)
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
(设计实验)
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)若假设二成立,则反应的化学方程式是_______________________。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解,_________________________ | _______________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

该反应的△H=________________________。
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式______________________________________。

(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是___________。
Ⅱ为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下:N2(g)+3H2(g) ![]() 2NH3(g),若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
2NH3(g),若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:

(1)0-25min内,反应的平均速率v(H2)为_________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试分析有机物下列性质中该有机物不具有的是:( )  ;(1)加聚反应(2)加成反应 (3)使酸性高锰酸钾溶液褪色(4)与NaHCO3溶液反应放出CO2气体 (5)与KOH溶液反应.
;(1)加聚反应(2)加成反应 (3)使酸性高锰酸钾溶液褪色(4)与NaHCO3溶液反应放出CO2气体 (5)与KOH溶液反应.
A.(1)(3)
B.(2)(4)
C.(4)
D.(4)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com