
【题目】计算:
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为____mol·L-1。
(2)若从中取出50mL,其物质的量浓度为____mol·L-1;溶质的质量为___g。
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为____mol·L-1,SO42-的物质的量浓度为_____mol·L-1。
(4)已知:a g某气体A含有b个分子,则c g该气体在标准状况下的体积为____ L。
【答案】0.2 0.2 1.42 0.2 0.1 ![]()
【解析】
(1)根据n=m/M计算硫酸钠的物质的量,再根据c=n/V计算;
(2)溶液是均匀的,取出50mL溶液的浓度与原溶液浓度相等;含有溶质质量为原溶液中的1/10;
(3)根据稀释定律计算稀释后Na+、SO42-的物质的量浓度;
(4)根据ag气体的分子数为b,可知此气体的摩尔质量为M=NAag/bmol=a·NA/bg·mol-1.
(1)14.2g硫酸钠的物质的量=14.2g/142g·mol-1=0.1mol,溶于水配成500mL溶液,所得溶液物质的量浓度为0.1mol/0.5L=0.2mol·L-1;
(2)溶液是均匀的,取出50mL溶液的浓度与原溶液浓度相等为0.2mol·L-1;含有溶质质量为原溶液中的1/10,含有溶质的质量=14.2g×1/10=1.42g;
(3)根据稀释定律,稀释后Na+的物质的量浓度=0.2mol·L-1×2×0.05L/0.1L=0.2mol·L-1;SO42-的物质的量浓度=0.2mol·L-1×1×0.05L/0.1L=0.1mol·L-1;
(4)根据ag气体的分子数为b,可知此气体的摩尔质量为M=NAa g/b mol=a·NA/b g·mol-1,则c g该气体的物质的量n=m/M= =bc/aNA mol,在标况下的体积为
=bc/aNA mol,在标况下的体积为![]() L。
L。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】元素X的原子,其M层与K层电子数相同;元素Y的原子,其L层上有5个电子。X和Y所形成的稳定化合物的式量为( )
A. 100B. 90C. 88D. 80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某温度时,1LpH = 6的水溶液,含1.0×10-6molOH-离子
B. 含10.6g Na2CO3溶液中,所含阴离子总数等于0.1mol
C. 用TiCl4制备TiO2:TiCl4 +(x+2) H2O(过量)= TiO2·xH2O↓+ 4HCl
D. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)![]() 2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
2C(g)ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是()
A. 若反应开始时容器体积为2L,则Vc=0.4molL-1min-1
B. 若在恒压绝热条件下反应,平衡后nc<1.6mol
C. 若2min后,向容器中再投入2mol A和1 mol B, B的转化率变大
D. 若该反应在恒温恒容下进行,放出热量将增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
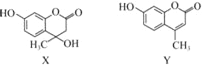
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。20℃时,配制一组c(H2A)+c(HA﹣)+c(A2﹣)=0.100molL﹣1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
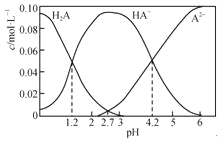
A. H2A的Ka1=10﹣1.2
B. pH=4.2的溶液中:c(HA﹣)=c(A2﹣)=0.050 molL﹣1
C. pH=7的溶液中:c(Na+)>2c(A2﹣)+c(H+)
D. c(Na+)=0.150 molL﹣1的溶液中:2c(OH﹣)+c(HA﹣)+3c(H2A)=2c(H+)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
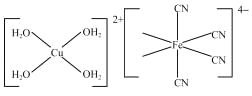
【题目】K4[Fe(CN)6]可用于生产油漆、药物等。
(1)Fe2+的核外电子排布式为_____。
(2)CN﹣中C原子轨道的杂化类型为_____。与CN﹣互为等电子体的一种分子的结构式为_____。
(3)[Cu(H2O)4]2+结构示意图如图所示。[Fe(CN)6]4﹣结构示意图如图所示,请在图中相应位置补填配体_________。
(4)已知3K4Fe(CN)6![]() 12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
12KCN+Fe3C+3C+(CN)2↑+2N2↑.(CN)2分子中σ键与π键的数目比n(σ):n(π)=_____。
(5)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着局部示意如图所示。则铁表面上氮原子与铁原子的数目比为_____。
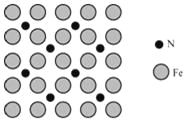
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为H2与O2反应生成H2O(g)的能量变化示意图:
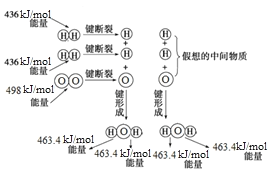
下列有关叙述不正确的是
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com