
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Fe3+ | 2.7 | 3.7 |
| 实验 编号 | 待测溶液的体积(mL) | 滴定前标液的 体积读数(mL) | 滴定后标液的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 21.22 |
| 2 | 20.00 | 2.21 | 22.19 |
| 3 | 20.00 | 1.50 | 23.48 |
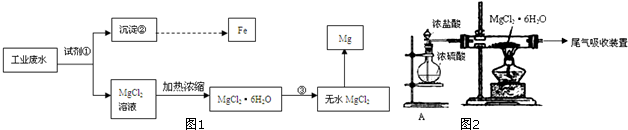
分析 (1)根据流程图可知,工业废水(主要含Mg2+、Fe3+、Cl-)加入试剂①后得氯化镁溶液和沉淀,沉淀经过一系列的变化得到铁,说明沉淀中有铁元素,所以试剂①的作用是使铁离子沉淀,而不使镁离子沉淀,据此判断;
(2)由于镁离子易水解,所以从氯化镁晶体中获得无水氯化镁要在氯化氢气流中进行,根据装置图可知,装置A就是用来制备氯化氢气体;
(3)①用高锰酸钾溶液滴定亚铁离子,由于在反应中高锰酸钾溶液的颜色会发生变化,所以不用指示剂;
②A.锥形瓶水洗后,用待测液润洗过再装待测液,则锥形瓶中待测液偏多;
B.滴定前读数仰视,滴定后读数俯视,则读出的标准液的体积偏小;
C.滴定管水洗后,未用标准液洗涤,则标准液被稀释,所用标准液体积偏大;
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失,则读出的标准液的体积偏大,据此分析;
③根据表中提供的数据可知,实验3的数据与前面两组数据偏差较大,为偶然误差,应舍去,所以在实验中用去的高锰酸钾溶液的体积为$\frac{20.02+19.98}{2}$mL=20.0mL,则高锰酸钾的物质的量为1.000×10-2mol•L-1×0.02L=2.000×10-4mol,根据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知亚铁离子的物质的量为1.000×10-3mol,所以5.000g废水中亚铁离子的物质的量为$\frac{100ml}{25.00ml}$×1.000×10-3mol=4.000×10-3mol,其质量为0.224g,根据$\frac{铁元素的质量}{样品的质量}$×100%计算铁元素的质量分数.
解答 解:(1)根据流程图可知,工业废水(主要含Mg2+、Fe3+、Cl-)加入试剂①后得氯化镁溶液和沉淀,沉淀经过一系列的变化得到铁,说明沉淀中有铁元素,所以试剂①的作用是使铁离子沉淀,而不使镁离子沉淀,即①的作用是使溶液的pH升高,使Fe3+转化为氢氧化铁沉淀而分离出去,可用MgCO3或Mg(OH)2,故选AB,
故答案为:AB;使溶液的pH升高,使Fe3+转化为氢氧化铁沉淀而分离出去;
(2)由于镁离子易水解,所以从氯化镁晶体中获得无水氯化镁要在氯化氢气流中进行,根据装置图可知,装置A就是用来制备氯化氢气体,
故答案为:制备干燥的HCl气体,抑制MgCl2的水解;
(3)①用高锰酸钾溶液滴定亚铁离子,由于在反应中高锰酸钾溶液的颜色会发生变化,自身可作指示剂,所以不用指示剂,
故答案为:否;KMnO4溶液自身可作指示剂;
②A.锥形瓶水洗后,用待测液润洗过再装待测液,则锥形瓶中待测液偏多,会使测量结果偏大;
B.滴定前读数仰视,滴定后读数俯视,则读出的标准液的体积偏小,会使测量结果偏小;
C.滴定管水洗后,未用标准液洗涤,则标准液被稀释,所用标准液体积偏大,会使测量结果偏大;
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失,则读出的标准液的体积偏大,会使测量结果偏大,
故选 ACD;
③根据表中提供的数据可知,实验3的数据与前面两组数据偏差较大,为偶然误差,应舍去,所以在实验中用去的高锰酸钾溶液的体积为$\frac{20.02+19.98}{2}$mL=20.0mL,则高锰酸钾的物质的量为1.000×10-2mol•L-1×0.02L=2.000×10-4mol,根据5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知亚铁离子的物质的量为1.000×10-3mol,所以5.000g废水中亚铁离子的物质的量为$\frac{100ml}{25.00ml}$×1.000×10-3mol=4.000×10-3mol,其质量为0.224g,所以铁元素的质量分数=$\frac{铁元素的质量}{样品的质量}$×100%=$\frac{0.224}{5.000}$×100%=4.480%,
故答案为:4.480%.
点评 本题主要考查了工业生产来提取镁的流程,侧重考查混合物分离提纯,把握流程中的分离方法为解答的关键,注意氯化镁的性质和制镁的方法,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 有机物 CH4 和CH3OH,不论以何种比例混合,混合物完全燃烧后,产生的水和二氧化碳的分子数比为2:1 | |
| B. | 为了除去甲烷中含有的少量乙烯气体,将混合气体通过酸性高锰酸钾溶液中洗气,可以得到纯净的甲烷气体 | |
| C. | 将a g CH2O、H2以及CO的混合气体在氧气中完全燃烧的产物,通过足量的过氧化钠固体,充分反应后,固体增重也是a g | |
| D. | 实验室制取乙炔时,可将生成的气体通过硫酸铜溶液,除去可能存在的H2S等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,l L 0.50 mol/LNH4C1溶液与2 L0.25mol/LNH4C1溶液NH4+的离子数均为0.5NA | |
| B. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA | |
| D. | pH=5的NaHSO4溶液中水电离出的氢离子数目为10-5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 在新生成的AgCl沉淀中滴入稀KI溶液,振荡 | 白色沉淀转化为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4, | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Br- |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热, | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com