
【题目】过氧化氢H2O2,(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是__(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是__(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为:_______标准状况),被氧化的HCl的物质的量为__。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为_________。
(6)下列物质中:①NaNO3固体、②熔融KCl、③液氨、④石墨、⑤氯化氢、⑥盐酸、⑦蔗糖。其中:
属于电解质的是:__(填序号,下同);
既不是电解质也不是非电解质的是:__。
【答案】 D C 5H2O2+![]() +6H+===2Mn2++8H2O+5O2↑ 3.36 L 0.3 mol 过滤 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ ①②⑤ ④⑥
+6H+===2Mn2++8H2O+5O2↑ 3.36 L 0.3 mol 过滤 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ ①②⑤ ④⑥
【解析】(1)O元素的化合价降低,只表现氧化性,则以上反应中H2O2仅体现氧化性的反应为D,故答案为:D;
(2)O元素的化合价升高也降低可体现氧化性、还原性,则以上反应中H2O2既体现氧化性又体现还原性的反应是C,故答案为:C;
(3)由氧化反应:H2O2-2e-═2H++O2↑、还原反应:MnO4-+5e-+8H+═Mn2++4H2O及电子守恒可知,该氧化还原反应的化学方程式为5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑,故答案为:5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑;
(4)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气的物质的量为: ![]() =0.15mol,在标准状况下的体积为:0.15mol×22.4L/mol=3.36L;反应中HCl被氧化成氯气,根据Cl元素守恒可知被氧化的HCl的物质的量为:0.15mol×2=0.3mol,故答案为:3.36L;0.3mol;
=0.15mol,在标准状况下的体积为:0.15mol×22.4L/mol=3.36L;反应中HCl被氧化成氯气,根据Cl元素守恒可知被氧化的HCl的物质的量为:0.15mol×2=0.3mol,故答案为:3.36L;0.3mol;
(5)除去镁粉中的少量铝粉,选用氢氧化钠溶液,Al与NaOH反应,而Mg不能,发生的反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应后过滤即可,故答案为:过滤;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(6)①NaNO3固体不能导电,是电解质;②熔融KCl能导电,是电解质;③液氨不能导电,是非电解质;④石墨是单质,能导电,既不是电解质也不是非电解质;⑤氯化氢不能导电,是电解质;⑥盐酸是溶液,能导电,既不是电解质也不是非电解质;⑦蔗糖不能导电,是非电解质;其中是电解质的是①②⑤;既不是电解质也不是非电解质的是④⑥,故答案为:①②⑤;④⑥。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是
A. 胶体为分散质粒子直径在10nm~100nm之间的分散系
B. 可利用过滤的方法分离胶体和溶液
C. 溶液是混合物,胶体是纯净物
D. 利用丁达尔效应可以区别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碳酸钙的摩尔质量是100g
B. 摩尔既是微粒数目的单位,也是物质的量的单位
C. 阿伏加德罗常数的符号为NA,约为6.02×1023mol-1
D. 标准状况下,1mol任何物质的体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据:
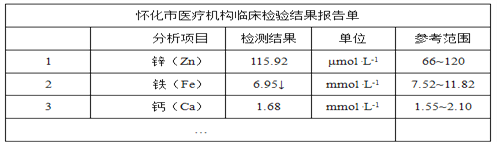
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
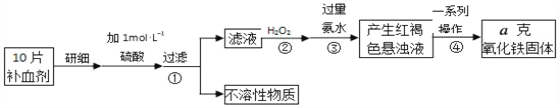
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]. 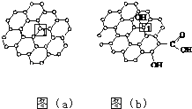
(1)图(a)中,1号C与相邻C形成σ键的个数为 .
(2)图(b)中,1号C的杂化方式是 , 该C与相邻C形成的键角(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角.
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g碳在一定量的氧气中燃烧,反应后生成的混合气体相对氢气的密度是16,则生成的一氧化碳的质量是(相对密度指在相同的温度和压强下物质的密度之比)
A. 3.3 g B. 6.3 g C. 8.4 g D. 13.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中能大量共存,加入H2SO4溶液后既有气体放出又有沉淀生成的一组是( )
A.Ba2+、NO ![]() 、NH
、NH ![]() 、Cl﹣
、Cl﹣
B.Ba2+、HCO ![]() 、NH
、NH ![]() 、NO
、NO ![]()
C.K+、Cu2+、Cl﹣、OH﹣
D.Na+、CO ![]() 、SO
、SO ![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
接通电源,经过一段时间后,测得丙中K2SO4的质量分数为10.47%,乙中c电极质量增加.回答问题: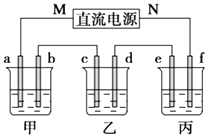
(1)电源的N端为极;
(2)电极b上发生的电极反应式为;
(3)丙装置损失的质量为(该处保留两位有效数字);电极b上生成的气体在标准状况下的体积为;
(4)电极c的质量变化是g;
(5)①若该直流电源为甲烷燃料电池,电解质溶液为KOH溶液.通入甲烷的铂电极上发生的电极反应式为 .
②已知上述燃料电池中,每转移1mol电子,就有 112KJ的化学能转化为电能.写出常温下甲烷燃烧的热化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com