
【题目】几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )

A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 与稀盐酸反应的剧烈程度:M单质<X单质
【答案】D
【解析】
短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为氯元素;X、M均有+2价,处于ⅡA族,原子半径X>M,则X为Mg元素、M为Be;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al元素,结合元素周期律及物质的结构与性质解答。
A.X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;
B.Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;
C. 非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故C错误;
D. 金属性Mg>Be,故Mg与盐酸反应更剧烈,故D正确,
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
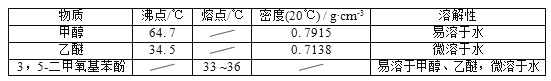
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:

(1)元素①可与18O组成多种水分子,其相对分子质量的最大值为_____;元素①可与元素②形成一种由五个原子构成的+1价阳离子,该离子所含电子数为____________;
(2)判断:已知元素④的非金属性比⑧强,故④的单质可以从⑧的可溶性盐溶液中置换出⑧的单质___。(填“正确”或“错误”)。
(3)元素⑤⑦的最高价氧化物的水化物发生反应的化学方程式为_________;
(4)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
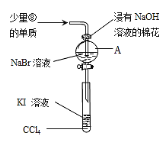
①A中发生的反应的离子方程式是_______;
②棉花中浸有的NaOH溶液的作用是_______;
③VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,____,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氯化铵受热固体消失和干冰升华只需克服分子间作用力
B. NaF、H2SO4中所含化学键类型相同
C. I2、Br2、Cl2、F2熔沸点逐渐升高
D. HCl气体溶于水和NaOH熔化破坏的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___与盐酸反应最剧烈,_____与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:__。
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律

(3)仪器A的名称为____。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉—碘化钾混合溶液,观察到C中溶液____现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____的现象,反应的离子方程为: _____。有同学认为实验无法证明C非金属性大于Si,请指出实验设计的不足之处,并进行改进: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
(1)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下:
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=__________。
W(s)+3H2O(g) K=__________。
(2)T1℃时,将4molH2和足量WO3置于2 L密闭容器中,发生反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
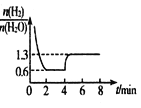
①下列选项中能说明反应已经达到平衡的是_________。(填字母)
a.反应速率ν(H2)=ν(H2O)
b.每断裂3molH-H键的同时断裂3molO-H键
c.反应热不变
d.混合气体的密度不再改变
e.体系的压强不再改变
②反应在2min时达到平衡,此时H2的平衡转化率a=_________%。
③若在4min时升高并维持温度为T2℃,变化如图所示,则该反应的△H_______0,若在8min时缩小容器容积,则![]() ________1.3。(填“>”“ <”或“=”)
________1.3。(填“>”“ <”或“=”)
(3)利用电解法可以从合金碳化钨(WC)废料中回收钨元素(合金中钨、碳均为单质)。电解时,用合金碳化钨做阳极,不锈钢做阴极,盐酸溶液为电解液,阳极析出钨酸(H2WO4)并放出CO2。该阳极的电极反应式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com