
【题目】为了鉴定卤代烃中所含有的卤素原子,现有下列实验操作步骤.正确的顺序是( ) ①加入AgNO3 ②加入少许卤代烃试样 ③加热 ④加入5mL 4mol/L NaOH溶液 ⑤加入5mL 4mol/L HNO3溶液.
A.②④③①
B.②④③⑤①
C.②⑤③①④
D.②⑤①③④
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl﹣、CO32﹣、SO42﹣中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
①一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
②另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(保准状况).
下列说法正确的是( )
A.该固体中一定含有NH4+、SO42﹣、Na+
B.该固体中一定没有Cu2+、Cl﹣
C.该固体中只含有NH4+、CO32﹣、SO42﹣、Cl﹣
D.根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废塑料的回收再生利用将工业垃圾变成极有价值的工业生产原料。具有不可忽略的潜在意义。利用如图所示的装置隔绝空气加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,以此探究废塑料的再利用。下列叙述正确的是

A. 聚丙烯的链节是-CH2-CH2-CH2-
B. 装置乙的试管中收集到的物质不能使酸性高锰酸钾溶液褪色
C. 装置丙中的试剂可吸收烯烃且出现溶液分层现象
D. 最后收集的气体可作燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。使Ba(OH)2·8H2O与NH4Cl充分反应。实验中观察到的现象是______________________,说明该反应是___________热反应,这是由于反应物所具有的总能量_________ (填“大于”、“小于”或“等于”生成物所具有的总能量。
(2)将Fe+2FeCl3=3FeCl2设计为一个原电池,则该电池的负极材料为__________,正极电极反应式为__________________________________。
(3)恒温下,将amo1N2与bmolH2的混合气体通入一容积固定的密闭容器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 .
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为gcm﹣3(列出计算式即可).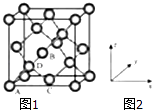
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲气体和1L乙气体恰好完全反应生成2L丙气体,若丙气体的分子式为XY2,则甲、乙的分子式为:( )
A.X2与Y2B.XY与Y2C.X2与XYD.YX2与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气还原氧化铜:CuO + H2 = Cu + H2O,在该反应中,( )
A.CuO做还原剂B.CuO做氧化剂
C.氢元素化合价降低D.铜元素化合价升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 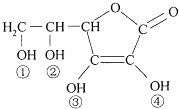
A.维生素C由于含有C═O键而能发生银镜反应
B.维生素C由于含有酯基而难溶于水
C.维生素C的分子式为C6H8O6
D.维生素C的酸性可能是①、②两个羟基引起的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com