
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.四氯化碳可萃取溴水中的溴;
B.氢氧化钠过量,氢氧化钠和氯化镁、氯化铁反应都生成沉淀;
C.蔗糖水解生成葡萄糖,与银氨溶液的反应应在碱性条件下;
D.强酸反应制取弱酸.
解答 解:A.四氯化碳可萃取溴水中的溴,溴和四氯化碳的沸点不同,可用蒸馏分离,故A正确;
B.氢氧化钠过量,氢氧化钠和氯化镁、氯化铁反应都生成沉淀,所以不能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀,故B错误;
C.蔗糖水解生成葡萄糖,葡萄糖能发生银镜反应,故C正确;
D.强酸反应制取弱酸,最高价氧化物的酸性越强,元素的非金属性越强,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离提纯、沉淀转化、物质检验以及非金属性比较等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
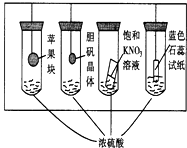
| A. | 苹果块会干瘪 | B. | 胆矾晶体表面有“白斑” | ||
| C. | 小试管内有KNO3晶体析出 | D. | 蓝色石蕊试纸变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
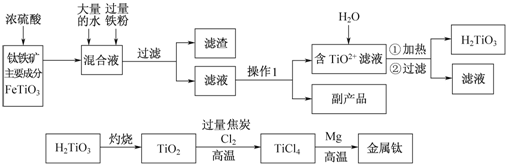
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液肯定只存在NH4+、SO32- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
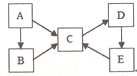 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

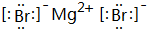
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
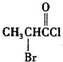 、
、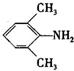 是合成施安卡因(
是合成施安卡因(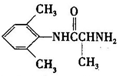 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: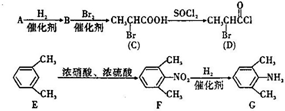 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.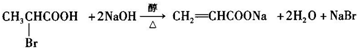 ;
;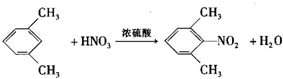 ;
;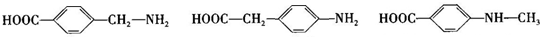 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
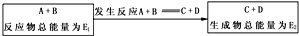
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com