
下列物质是弱电解质的是( )
|
| A. | CO2 | B. | NaCl | C. | Br2 | D. | H2O |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
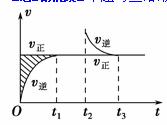
、恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
X(g)+Y(?);ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是 ( )
A.Z和W在该条件下都不可能为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中
气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应
的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L的盐酸.
|
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定的四种溶液中加入以下各种离子,各离子能在原溶液中共存的是( )
|
| A. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl﹣、SCN﹣ |
|
| B. | pH为1的溶液:Cu2+、Na+、Mg2+、NO3﹣ |
|
| C. | 水电离出来的c(H+)=10﹣13mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+ |
|
| D. | 所含溶质为Na2SO4的溶液:K+、CO32﹣、NO3﹣、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为 = ;已知C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2 (g)⇌2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1,C(O2)=1mol•L﹣1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=a kJ•mol﹣1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 室温下,将pH=2 H2SO4与pH=12 NH3•H2O溶液等体积混合后,混合液pH<7 |
|
| B. | 室温下,将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混合液13<pH<14 |
|
| C. | 室温下,将pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7 |
|
| D. | 某温度下水的离子积为1×10﹣12,若使pH=1 H2SO4与pH=12 NaOH溶液混合后溶液呈中性,则两者的体积比 为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2⇌PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
|
| A. | 0.40mol | B. | 0.20mol |
|
| C. | 小于0.20mol | D. | 大于0.20mol,小于0.40mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)101kPa时,1mol纯物质完全燃烧生成 时所放出的热量,叫做该物质的燃烧热,单位 ,在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为 .
(2)在与外界隔离的体系中,自发过程将导致体系的熵 ,(填“增大”、“减小”、“不变”). 对于同一种物质, 时熵值最大.(填“固态”、“液态”、“气态”)
(3)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol﹣1):
| 化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
| 键能 | 414 | 489 | 565 | 158 |
根据键能数据计算以下反应的反应热△H:CH4(g)+4F2(g)=CF4(g)+4HF(g)△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组需要2mol•L﹣1的NaCl溶液98ml,现用NaCl固体来配制,请回答下列问题:
(1)需称取NaCl11.7g
(2)配制过程中,不需要的仪器(填序号) .
A.药匙 B.酒精灯 C.托盘天平 D.烧杯 E.玻璃棒 F.洗瓶 G.蒸发皿
完成实验还缺少的仪器是 .
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有 (填序号).
①称量NaCl固体时,砝码与NaCl固体位置放反(1g以下用游码)
②所称取的NaCl固体含有其他杂质 ③转移前,容量瓶中含有少量蒸馏水
④定容时,俯视刻度线 ⑤转移时有少量液体溅出
(4)该实验小组用上述配制的溶液进行如右图所示的电解实验.
①写出该电解反应的化学方程式,并在化学方程式上标出电子转移的方向和数目: ;
②电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分震荡,最后观察到的现象是 .
A.溶液分层,上层无色,下层橙红色
B.溶液分层,上层橙红色,下层无层
C.溶液分层,上层无色,下层紫红色
D.溶液分层,上层紫红色,下层无层
③写出工业用Y极生成的物质来制取漂白粉的化学方程式: 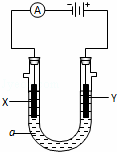
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com