
| A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸 |
| B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性 |
| C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡 |
| D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 | |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 | |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 | |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| B | 除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 证明氯乙烷中含氯元素 | 向氯乙烷中滴几滴AgNO3溶液再滴加稀HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
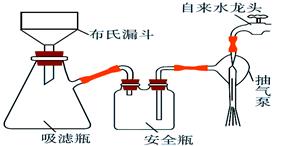
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| B.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| C.在高锰酸钾溶液中加入适量锌粉、振荡、静置后紫红色褪去,表明MnO4-为紫红色 |
| D.将高锰酸钾晶体加热分解,所得的固体质量减轻 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
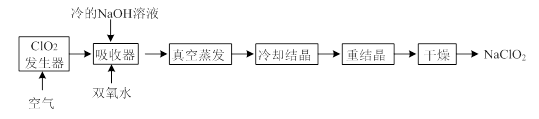
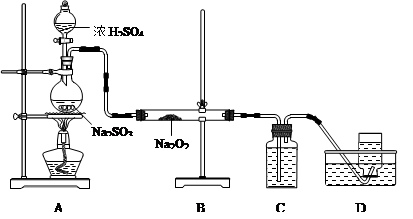
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
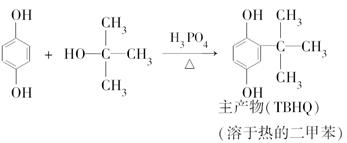
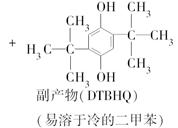
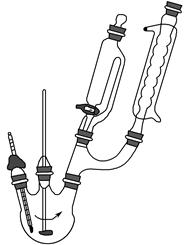
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com