
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:
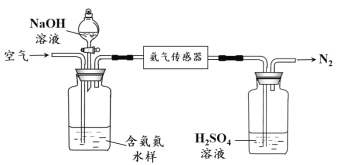
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
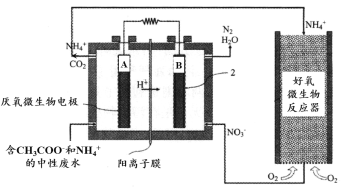
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
【答案】-1 c(NaClO)增大,水解平衡正向移动,使c(HClO)增大,NH3被氧化为N2速度加快。 ClO- + H2O ![]() HClO + OH- pH较大时,c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱,去除率降低。 pH较小时,c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解,去除率降低。负极 Cl-- 2e- + H2O = H+ + HClO
HClO + OH- pH较大时,c(OH-)较大,抑制NaClO水解,c(HClO)较小致氧化能力弱,去除率降低。 pH较小时,c(H+)较大,促进NaClO水解,c(HClO)太高致HClO易分解,去除率降低。负极 Cl-- 2e- + H2O = H+ + HClO
【解析】
试题本题考查工业上合成氨和氨催化氧化反应方程式的书写,外界条件对电离平衡的影响,氧化还原反应的计算,原电池原理和电极反应式的书写。
(1)①工业上用N2和H2化合成氨气,反应的化学方程式为N2+3H2![]() 2NH3。
2NH3。
②氨发生催化氧化生成NO和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(2)①在氨氮水样中存在平衡:NH4++OH- ![]() NH3·H2O
NH3·H2O![]() NH3+H2O,加入NaOH溶液电离出OH-,OH-浓度增大,平衡正向移动,有利于生成NH3,而被空气吹出。
NH3+H2O,加入NaOH溶液电离出OH-,OH-浓度增大,平衡正向移动,有利于生成NH3,而被空气吹出。
②水样中N元素的化合价为-3价,则1mol水样中氮原子被氧化为N2转移3mol电子,转移电子物质的量为6![]() 10-4mol,被氧化的NH3物质的量为2
10-4mol,被氧化的NH3物质的量为2![]() 10-4mol,被氧化的NH3的质量为2
10-4mol,被氧化的NH3的质量为2![]() 10-4mol
10-4mol![]() 17g/mol=3.4mg,水样中氨氮含量为3.4mg
17g/mol=3.4mg,水样中氨氮含量为3.4mg![]() 1L=3.4mg/L。
1L=3.4mg/L。
(3)①根据图示B极为NO3-得电子被还原成N2,B极电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,A、B两极生成的CO2和N2物质的量之比为5:2,根据正负极得失电子相等,则1molCH3COO-失去8mol电子生成2molCO2,A极的电极反应式为CH3COO--8e-+2H2O=2CO2+7H+。
②根据图示知NH4+去除的原理是:NH4+在好氧微生物反应器中转化为NO3-:NH4++2O2=NO3-+2H++H2O,NO3-在MFC电池正极转化为N2:2NO3-+12H++10e-=N2+6H2O。


科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
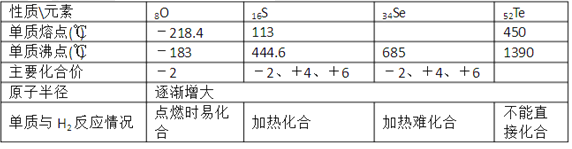
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料报道,前几年我国部分地区陆续发现了“毒油”。所谓“毒油”,是指混有汽油的食用油,不能食用。下列有关说法正确的是( )
A.汽油是纯净物,有固定的熔、沸点
B.汽油只能由石油分馏得到
C.可用分液的方法分离汽油和食用油的混合物
D.汽油中烃分子内所含碳原子数为5~11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
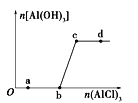
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:K+、Ag+、Ca2+、NO3-
D. d点对应的溶液中:K+、NH4+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
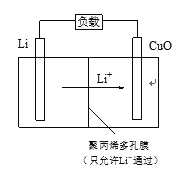
【题目】Li—CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域。
(1)Li—CuO电池中,金属锂做_______极 。
(2)比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣。比较Li、Na、Al分别作为电极时比能量的大小:____________。
(3)通过如下过程制备CuO。
![]()
①过程Ⅰ,H2O2的作用是__________________。
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是_____________________。
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%。
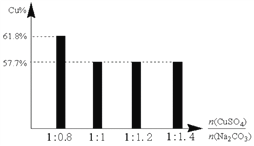
二者比值为1:0.8时,产品中可能含有的杂质是_____________,产生该杂质的原因是_________________________________。
④ 过程Ⅲ反应的化学方程式是_________________________。
(4)Li—CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如下。放电时,正极的电极反应式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物已略)。下列说法不正确的是
![]()
A. X、Y、Z中至少有一种相同的元素,该元素可以是金属元素也可以是非金属元素
B. 物质W可能是化合物,也可能是单质
C. 上述转化关系中不可能出现置换反应
D. 若X、Y、Z中均含有一种常见金属元素,则W可能是强酸也可能是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,在酸性条件下CNO-继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
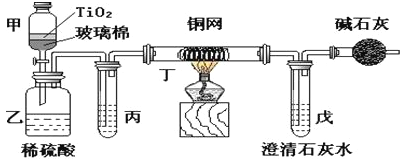
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 molL-1倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为________________________,乙中反应的离子方程式为________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是_____________________,丁在实验中的作用是______________,装有碱石灰的干燥管的作用是______________________________。
(3)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于__________。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能原因之一_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com