
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A.氧元素、氟元素没有最高正化合价;
B.能量高的电子在离核较远的区域内运动;
C.长周期元素中ⅡA族、ⅢA族之间相隔10列;
D.过渡元素为长周期中第3列~12列元素.
解答 解:A.氧元素、氟元素没有最高正化合价,氧元素、氟元素除外,主族元素原子的最外层电子数等于元素的最高化合价,故A错误;
B.离核较近的区域能量较低,多电子原子中,能量高的电子在离核较远的区域内运动,故B错误;
C.短周期中,同周期第ⅡA族与第ⅢA族的元素原子序数之差为1,但长周期元素中ⅡA族、ⅢA族之间相隔10列,故同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1,故C正确;
D.过渡元素为长周期中第3列~12列元素,故D错误.
故选:C.
点评 本题考查元素周期表与元素周期律、核外电子排布等,难度不大,注意元素化合价与族序数的关系,注意副族元素与O、F元素特殊性.


科目:高中化学 来源: 题型:选择题
| A. | 放电时溶液中的H+向负极移动 | |
| B. | 在放电时,正极发生的反应是 Pb(s)+SO42-(aq)=PbSO4(s)+2e- | |
| C. | 在放电时,该电池的负极材料是铅板 | |
| D. | 放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 常温下,pH=10的氨水溶液中,由水电离出的c(H+)=10-10mol/L | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
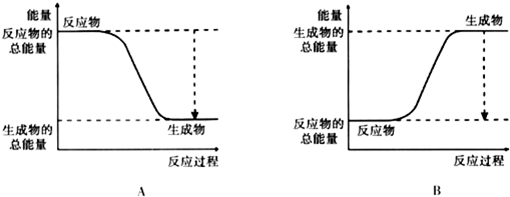
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
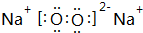 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
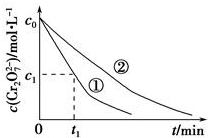 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com