
| A. | 通入大量O2 | B. | 增大容器容积 | C. | 移去部分SO3 | D. | 降低体系温度 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
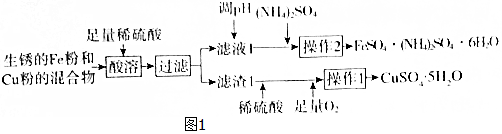
| FeSO4•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=1000Wρ/M | B. | m=VρW/100 | C. | W%=cM/1000ρ% | D. | c=100m/VM |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L He分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | K+、NO3-、OH-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | SO42-、NH4+、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
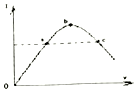 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10ml | 20.30ml |
| 第二次 | 0.30ml | 20.10ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(c)=0.2mol/(L•s) | B. | z=3 | ||
| C. | B的转化率为75% | D. | 反应前与2s后容器的压强比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com