
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
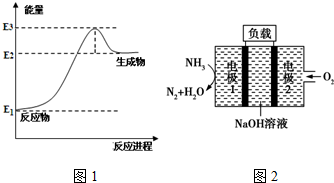
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.68 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验 | |
| B. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| C. | 向试管中先加入无水乙醇,再加入适量冰醋酸与一定量浓硫配制的混酸,然后加热制取乙酸乙酯 | |
| D. | 验证蔗糖水解产物时,将反应后的溶液与银氨溶液混合水浴加热,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2++CO32-+2H+=Ba(NO3)2+H2O+CO2↑ | |
| B. | BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | BaCO3+2H++2NO3-=Ba(NO3)2+H2O+CO2↑ | |
| D. | CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 制作Fe(OH)3胶体时,应将蒸馏水与FeCl3溶液混合加热,煮沸至液体呈红褐色 | |
| C. | 各放一张质量相同的滤纸于天平两托盘上,将Na2CO3固体放在右盘纸上称量 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
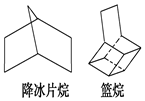 如图都是简化的碳架结构:
如图都是简化的碳架结构:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com