
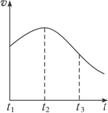
图2-8
(1)其中t1—t2化学反应速率变化的主要原因是___________________________________。
(2)t2—t3化学反应速率变化的主要原因是________________________________________。
思路解析:从图中可知速率曲线从t1时某一高度上升到t2后下降,这与盐酸的浓度随反应进行:t1→t2→t3逐渐减小,速率也应逐渐减小矛盾,然而事实就是这样。如何从影响反应速率的其他外界因素——压强、温度、催化剂角度去分析呢?从反应本质和反应外界条件来看,压强、催化剂(没加入催化剂)的影响均可排除,温度的影响是重点对象和关键。若从温度的影响来看肯定是升高了反应体的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致。t2→t3主要是浓度减小占主要影响因素了,即在镁条与稀盐酸反应过程中,影响化学反应速率的主要因素有氢离子浓度的降低和反应放热使温度升高,当反应放热使温度升高对化学反应速率的影响大于氢离子浓度降低对化学反应速率的影响时,曲线呈上升趋势。t2—t3段,氢离子浓度降低对化学反应速率的影响大于反应放热反应温度升高对化学反应速率的影响,曲线呈下降趋势。
答案:(1)温度升高对化学反应速率的影响大于氢离子浓度降低对化学反应速率的影响,曲线呈上升趋势
(2)氢离子浓度降低对化学反应速率的影响大于放热反应温度升高对化学反应速率的影响,曲线呈下降趋势


科目:高中化学 来源: 题型:
 (1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为
(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为 2Z
2Z 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:
图2-2
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省长葛市天阳中学高一下学期期中考试化学试卷 题型:填空题
把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1—t2速率变化的主要原因是______________________________;t2—t3速率变化的主要原因是________________________________________。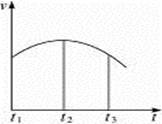
查看答案和解析>>
科目:高中化学 来源:2013届河南省长葛市高一下学期期中考试化学试卷 题型:填空题
把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1—t2速率变化的主要原因是______________________________;t2—t3速率变化的主要原因是________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com