
·ÖĪö £Ø1£©2min“ļµ½Ę½ŗā£¬CµÄÅضČĪŖ1.2mol/L£¬½įŗĻv=$\frac{”÷c}{”÷t}$¼ĘĖć£»
£Ø2£©2A£Øg£©+B£Øg£©?xC£Øg£©+2D£Øs£©£¬
æŖŹ¼ 2 2 0 0
×Ŗ»Æ 1.6 0.8
Ę½ŗā 0.4 1.2
ŅŌ“Ė¼ĘĖć×Ŗ»ÆĀŹ£»
£Ø3£©ĄūÓĆĘ½ŗāµÄĢŲÕ÷”°µČ”¢¶Ø”±¼°ÓÉ“ĖŃÜÉśµÄĪļĄķĮæĄ“ÅŠ¶ĻĘ½ŗā£»
£Ø4£©“ӵȊ§Ę½ŗāµÄ½Ē¶Č·ÖĪö£»
£Ø5£©ÓūŹ¹·“Ó¦“ļµ½Ę½ŗāŹ±CµÄĪļÖŹµÄĮæ·ÖŹżÓėÉĻŹöĘ½ŗāĻąµČ£¬ÓėŌĘ½ŗāĪŖµČŠ§Ę½ŗā£¬øł¾ŻB”¢CµÄĮææÉÖŖx=3£¬·“Ó¦Ē°ŗóĘųĢåµÄ»Æѧ¼ĘĮæŹż²»±ä£¬ĘšŹ¼¼ÓČėµÄA”¢BĪļÖŹµÄĮæn£ØA£©£ŗn£ØB£©Ó¦ÓėŌĘ½ŗāĻąµČ£®
½ā“š ½ā£ŗ£Ø1£©2min“ļµ½Ę½ŗā£¬CµÄÅضČĪŖ1.2mol/L£¬ÓÉv=$\frac{”÷c}{”÷t}$=$\frac{1.2mol/L}{2min}$=0.6mol/£ØL£®min£©£¬¹Ź“š°øĪŖ£ŗ0.6mol/£ØL£®min£©£»
£Ø2£©2A£Øg£©+B£Øg£©?xC£Øg£©+2D£Øs£©£¬
æŖŹ¼ 2 2 0 0
×Ŗ»Æ 1.6 0.8
Ę½ŗā 0.4 1.2
ŌņA”¢BµÄ×Ŗ»ÆĀŹÖ®±ČĪŖ$\frac{1.6}{2}$£ŗ0.4=2£ŗ1£¬¹Ź“š°øĪŖ£ŗ2£ŗ1£»
£Ø3£©2A£Øg£©+B£Øg£©?3C£Øg£©+2D£Øs£©£¬
¢Ł2minŹ±·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬“ĖŹ±Ź£Óą1.2mol B£¬ŌņBµÄ·“Ó¦ĖŁĀŹĪŖ$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/£ØL£®min£©£¬ÓÉ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±ČæÉÖŖ£¬x=3£¬øĆ·“Ó¦ÖŠŃ¹ĒæŹ¼ÖÕ²»±ä£¬²»ÄÜÅŠ¶ĻĘ½ŗā£¬¹Ź¢Ł“ķĪó£»
¢ŚAµÄĻūŗÄĖŁĀŹÓėCµÄĻūŗÄĖŁĀŹÖ®±ČĪŖ1£ŗ1£¬ÕżÄę·“Ó¦ĖŁĀŹ²»µČ£¬Ć»ÓŠ“ļµ½Ę½ŗāדĢ¬£¬¹Ź¢Ś“ķĪó£»
¢ŪŅņĘųĢåµÄÖŹĮæŌŚ±ä»Æ£¬ŌņĘųĢåĆÜ¶Č²»ŌŁ±ä»Æ£¬“ļµ½Ę½ŗā£¬¹Ź¢ŪÕżČ·£»
¢ÜAµÄĻūŗÄĖŁĀŹÓėBµÄĻūŗÄĖŁĀŹÖ®±ČĪŖ2£ŗ1£¬¹ŲĻµŹ¼ÖÕ“ęŌŚ£¬²»ÄÜÅŠ¶ĻĘ½ŗā£¬¹Ź¢Ü“ķĪó£»
¹Ź“š°øĪŖ£ŗ¢Ū£»
£Ø4£©ŅņĪŖøĆ·“Ó¦ĪŖĘųĢåĢå»ż²»±äµÄ·“Ó¦£¬ČōĻņŌĘ½ŗā»ģŗĻĪļµÄČŻĘ÷ÖŠŌŁ³äČė2mol AĘųĢåŗĶ2mol BĘųĢ壬¼“Ļąµ±ÓŚ½«ŌĘ½ŗāĢå»żŃ¹ĖõĪŖŅ»°ė£¬¶ų“ĖŹ±Ę½ŗā²»ŅĘ¶Æ£¬ÓÉÓŚ¼ÓČėAŗĶBŗóĘšŹ¼µÄĪļÖŹµÄĮæĪŖŌĄ“µÄĖ«±¶£¬ĖłŅŌĘ½ŗāŹ±BµÄĪļÖŹµÄĮæĪŖŌĄ“µÄĖ«±¶£¬¹ŹBµÄĪļÖŹµÄĮæĪŖ2.4mol£¬¹Ź“š°øĪŖ£ŗ2.4mol£»
£Ø5£©ÓūŹ¹·“Ó¦“ļµ½Ę½ŗāŹ±CµÄĪļÖŹµÄĮæ·ÖŹżÓėÉĻŹöĘ½ŗāĻąµČ£¬ÓėŌĘ½ŗāĪŖµČŠ§Ę½ŗā£¬ÓÉÓŚx=3£¬·“Ó¦Ē°ŗóĘųĢåµÄ»Æѧ¼ĘĮæŹż²»±ä£¬ĘšŹ¼¼ÓČėµÄA”¢BĪļÖŹµÄĮæn£ØA£©£ŗn£ØB£©Ó¦ÓėŌĘ½ŗāĻąµČĪŖ1£ŗ1£¬¼“n£ØA£©=n£ØB£©£¬
¹Ź“š°øĪŖ£ŗn£ØA£©=n£ØB£©£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć”¢·“Ó¦ĖŁĀŹ¼ĘĖć”¢Ę½ŗāדĢ¬ÅŠ¶Ļ”¢µČŠ§Ę½ŗāµČ£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬²ąÖŲæ¼²éѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦£¬×¢ŅāĄūÓĆ·“Ó¦ĖŁĀŹµÄ¹ŲĻµČ·¶ØxĪŖ½ā“šµÄ¹Ų¼ü£¬×¢ŅāĄķ½āµČŠ§Ę½ŗā¹ęĀÉ£¬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ¼īŠŌŃõ»ÆĪļ Ńõ»ÆĢś Fe2O3 | B£® | ĖįŠŌŃõ»ÆĪļ øɱł CO2 | ||
| C£® | Ėį ĮņĖį H2S | D£® | ¼ī “æ¼ī Na2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 150ml | B£® | 180ml | C£® | 200ml | D£® | 250ml |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½šŹō·¢ÉśøÆŹ“µÄŹµÖŹŹĒ£ŗM-ne-=Mn+ | |
| B£® | ½šŹō·¢ÉśµÄµē»ÆѧøÆŹ“±Č»ÆѧøÆŹ“ŅŖĘÕ±éµĆ¶ą | |
| C£® | ·ĄÖ¹½šŹōÉśŠāæÉŅŌĶعżĶæÓĶĘį”¢¶Ę½šŹōµČ·½·ØŌŚĘä±ķĆęø²øĒŅ»²ć±£»¤Ä¤ | |
| D£® | ŌŚøÖĢśÉĻĮ¬½ÓŅ»øöĶæéæÉŅŌ·ĄÖ¹øÖĢśÉśŠā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
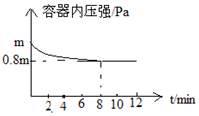 ĪŖµŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£®ŌŚT”ꏱ£¬½«0.6mol H2ŗĶ0.4mol N2ÖĆÓŚČŻ»ż2LµÄĆܱÕČŻĘ÷ÖŠ£ØŃ¹ĒæĪŖmPa£©·¢Éś·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0 Čō±£³ÖĪĀ¶Č²»±ä£¬²āµĆ·“Ó¦¹ż³ĢÖŠČŻĘ÷ÄŚŃ¹ĒæĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾£ŗ
ĪŖµŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠÓŠ×ÅÖŲŅŖ×÷ÓĆ£®ŌŚT”ꏱ£¬½«0.6mol H2ŗĶ0.4mol N2ÖĆÓŚČŻ»ż2LµÄĆܱÕČŻĘ÷ÖŠ£ØŃ¹ĒæĪŖmPa£©·¢Éś·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0 Čō±£³ÖĪĀ¶Č²»±ä£¬²āµĆ·“Ó¦¹ż³ĢÖŠČŻĘ÷ÄŚŃ¹ĒæĖꏱ¼ä±ä»ÆČēĶ¼ĖłŹ¾£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪŅ¹śĆ÷“śŅ½Ń§¼ŅĄīŹ±ÕäĖłÖųµÄŅ½Ń§ĆūÖųŹĒ£¼£¼ÉńÅ©±¾²Ż¾£¾£¾ | |
| B£® | Āé»Ę¼īŹĒ¹ś¼Ź°ĀĪÆ»įŃĻøń½ūÖ¹Ź¹ÓƵĊĖ·Ü¼Į | |
| C£® | ¶¾Ę·¾ĶŹĒÓŠ¶¾µÄŅ©Ę· | |
| D£® | ±ķŹ¾·Ē“¦·½Ņ©£¬±ķŹ¾“¦·½Ņ© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com