
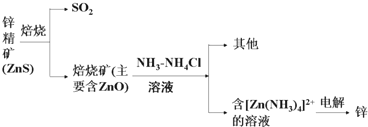
分析 Ⅰ.含锌矿的主要成分是ZnS,焙烧与空气中氧气发生氧化还原反应,2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO,氧化锌像氧化铝一样,属于两性氧化物,加入NH3、NH4Cl溶液,得到[Zn(NH3)4]Cl2溶液,电解阳极氯离子放电,阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,氧化锌与氢氧化钠反应ZnO+2OH-+H2O═[Zn(OH)4]2-;
(1)析锌一极应是[Zn(NH3)4]2+得到电子,还原为锌,同时释放出氨气;
(2)氧化锌像氧化铝一样,属于两性氧化物,与碱反应生成锌酸盐;
Ⅱ.(1)该原电池中正极上二氧化锰得电子发生还原反应;
(2)该原电池中,负极上Zn失电子和氢氧根离子反应生成ZnO和水;
析出108gAg单质转移电子的物质的量=$\frac{10.8g}{108g/mol}$=0.1mol,串联电路中转移电子相等,根据转移电子计算需要空气体积.
解答 解:Ⅰ.含锌矿的主要成分是ZnS,焙烧与空气中氧气发生氧化还原反应,2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO,氧化锌像氧化铝一样,属于两性氧化物,加入NH3、NH4Cl溶液,得到[Zn(NH3)4]Cl2溶液,电解阳极氯离子放电,阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,氧化锌与氢氧化钠反应ZnO+2OH-+H2O═[Zn(OH)4]2-,
(1)析锌一极应是[Zn(NH3)4]2+得到电子,在阴极[Zn(NH3)4]2++2e-═Zn+4NH3↑,还原为锌,
故答案为:[Zn(NH3)4]2++2e-═Zn+4NH3↑;
(2)根据题干信息,氧化锌像氧化铝一样,属于两性氧化物,与碱反应ZnO+2OH-+H2O═[Zn(OH)4]2-,
故答案为:ZnO+2OH-+H2O═[Zn(OH)4]2-;
Ⅱ.(1)锌锰碱性电池的总反应式为:Zn+2MnO2+2H2O═2MnO(OH)+Zn(OH)2,该原电池中正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
故答案为:2MnO2+2H2O+2e-═2MnO(OH)+2OH-;
(2)该原电池中,负极上Zn失电子和氢氧根离子反应生成ZnO和水,电极反应式为Zn-2e-+2OH-═ZnO+H2O;
析出108gAg单质转移电子的物质的量=$\frac{10.8g}{108g/mol}$=0.1mol,串联电路中转移电子相等,根据转移电子得需要空气体积=$\frac{\frac{0.1mol}{4}×22.4L/mol}{20%}$=2.8L,
故答案为:Zn-2e-+2OH-═ZnO+H2O;2.8.
点评 本题考查湿法炼锌工业、原电池原理、电解反应书写等,根据题干信息结合硫化锌的性质和电解原理是解题关键,题目难度中等


科目:高中化学 来源: 题型:推断题
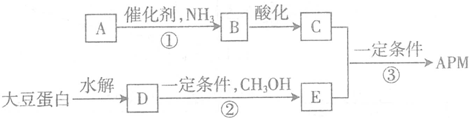
 ,C中所含官能团的名称为羧基、氨基.
,C中所含官能团的名称为羧基、氨基. .
.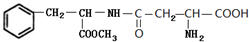 和
和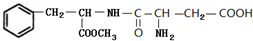 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 mL | B. | 72 mL | C. | 80 mL | D. | 128 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:Na+、Cu2+、Fe2+、NO3- | |
| B. | 使PH试纸变红的溶液中:Na+、Mg2+、SO42-、NH4+ | |
| C. | c(H+)=0.1mol•L-1的溶液:Na+、NH4+、SO42-、F- | |
| D. | 与铁粉反应放出H2的无色溶液:Na+、Cl-、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的3/8 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁强化酱油可通过膳食补充人体所需的铁元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: | |
| B. | 丙烷分子的比例模型: | |
| C. | NaHCO3的电离方程式NaHCO3=Na++H++CO32- | |
| D. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )
如图表示球棍模型,小球表示原子序数小于10的原子,短线表示化学键,每个原子都到达稳定结构.下列有关说法正确的是( )| A. | M分子的所有原子共面 | |
| B. | 0.1mol/L的N溶液中H+的物质的量浓度为0.1mol/L | |
| C. | L 存在同分异构体 | |
| D. | M、L都是烃类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com